最近高分辨率成像技术的发展使研究人员能够通过使用免疫荧光染色在其感兴趣的细胞和组织中可视化亚微米级甚至纳米级结构。然而,这需要在样品制备过程中进行仔细对步骤进行优化,以便获得清晰的图像,并且随着图像分辨率的提高,方案可能会变得更加苛刻。

尽管各种抗体制造商都提供了“最佳”方案,但遗憾的是没有可应用于所有样品类型的标准程序。事实上,大多数时候,研究人员需要通过反复试验找到最佳工作流程。
理论上,免疫荧光染色方案包括以下六个基本步骤:固定-透化-封闭-一抗孵育-二抗孵育以及图像采集。然而,在每一步都有许多小细节:当以一种或另一种方式完成时,可决定您是否获得良好的免疫荧光图像或糟糕的图像。
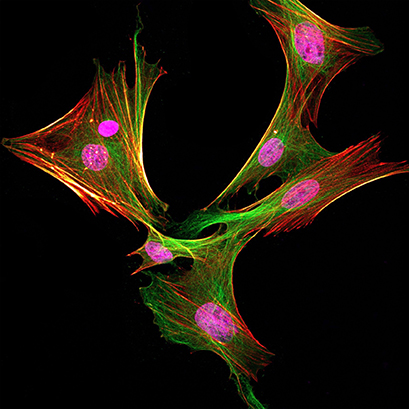
来自 Lewis 大鼠的骨-髓间充质干细胞用抗兔 PCNA 抗体(以洋红色显示)、抗 α-微管蛋白抗体(以绿色显示)和鬼笔环肽(以红热显示)染色。使用 Leica SP8 共聚焦显微镜获取图像。
自2017年作为理学硕士学生进入研究环境以来,我一直在研究各种类型的间充质干细胞和胚胎组织,研究颅面再生和发育。此外,我一直沉浸在免疫荧光染色的世界中,拍摄了无数图像,包括我的第一篇出版物(Yamada et al., 2019)《牙科研究杂志》的封面艺术。在每年花费近300小时进行荧光成像后,我发现了适合我的细胞和应用的完美免疫荧光方案。我了解到,这里和那里的一些小调整真的会有所作为!
在本文中,我将分享我的前5个基本但经常被忽视的优化步骤,这些步骤将改善您的免疫荧光细胞图像。
1. 了解您的目标蛋白并确定固定方案
首先要考虑的关键因素是决定为您的样品使用哪种固定剂。各种固定剂,包括醛类(例如,多聚甲醛:PFA)、酒精(例如,冰冷的甲醇)和酸基溶液已显示出与免疫荧光出色的相容性,但是这些固定剂中的每一种都有其优点和缺点。PFA和甲醇是很好的选择。您可以在文献中了解它们在固定特性方面的差异(例如Eldred et al., 1983)。
无论您选择哪种固定剂,优化固定时间至关重要。应避免过度固定,因为它会对细胞造成破坏性影响并恶化抗体识别(图 1A)。然而,人们也应该避免固定不足,因为它允许您的靶向蛋白质从其天然位点移动并扩散到“外部世界”。这不仅会导致模糊图像,还会导致假阳性染色。
时间很重要,温度同样也很重要。低温使反应缓慢且对细胞的破坏性较小,但它可能使蛋白质有时候在被固定之前四处移动。通常,当使用强/速-效固定剂(如冰冷的甲醇)时,优选在低温下固定。对于较温和的固定剂,如PFA,在环境温度下固定可能更合适,至少对于单层细胞。
我曾经盲目地遵循“4% PFA 室温 15 分钟”的规则,但后来我发现我的样品固定不足,浪费了很多时间和资源。这可能不会经常发生,但它会发生。如有疑问,请仔细检查您的固定方案!
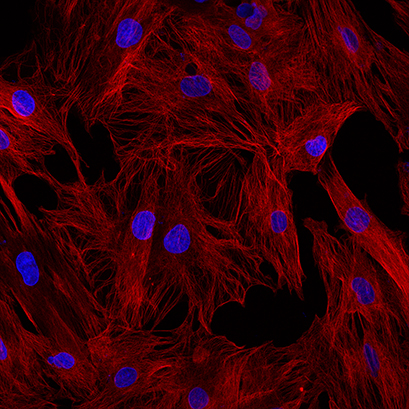
图 1A:过度固定的示例。甲醇在室温下使用 15 分钟。红色和细胞核中的 α-微管蛋白,蓝色的 DAPI 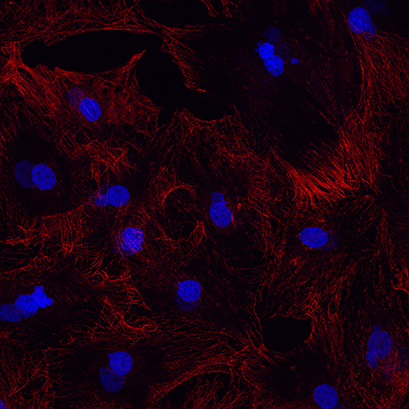
图 1B:正确固定细胞的示例:-20 度冰冷的甲醇 5 分钟。红色的α-微管蛋白和蓝色的细胞核 *DAPI
2. 确定使用哪种洗涤剂以及何时使用(或不使用)
当需要透化时,非离子去污剂(例如,Triton X-100 和 Tween-20)通常不仅包含在透化缓冲液中,而且还经常包含在封闭缓冲液、洗涤缓冲液和染色缓冲液中。这是因为去污剂的使用实际上提高了封闭效率,并在洗涤步骤中去除了非特异性抗体结合。但是,如果您的靶向蛋白(尤其是在细胞膜或细胞骨架上)在您的图像中显示的数量低于您的预期,则洗涤剂可能会干扰免疫染色。
Triton X-100 和 Tween-20 具有不同的化学特性,但最重要的是,Triton X-100 比 Tween-20 更强大地渗透细胞膜。如果在透化步骤中使用 Triton X-100,您可以选择是继续在洗涤、封闭和染色缓冲液中使用 Triton X-100,还是改用 Tween-20,甚至继续没有任何清洁剂。或者,您可能只想使用 Tween-20 进行渗透。最后,不要忘记有时您根本不需要清洁剂。
3. 浓度低,但孵化时间长
使用最少量的抗体对于提高信背比极为重要。我总是建议使用抗体滴定来确定最低工作浓度,即使制造商可能会提出最佳浓度。通常,与高抗体剂量的较短孵育时间相比,低抗体浓度的较长孵育时间(例如,4°C,过夜)提供更清晰、更强和更特异性的染色模式。抗体滴定有时很费力,需要额外的资源和时间,但一旦确定了最佳工作浓度,您就不会后悔。
4. 洗 洗 洗
洗涤可能是免疫荧光染色过程中最重要的步骤。相信我,一个人永远不会后悔额外的洗涤步骤!只要使用高质量的抗体,抗原-抗体结合就足够强,可以承受“额外的”洗涤步骤,同时有效去除弱结合或非特异性结合的抗体。一个微弱的低语可能即将从你的嘴唇中发出,“它既费时又单调。”我知道,但洗涤确实让您的形象从好到更好!多增加一两个洗涤步骤,让您有时间享用一杯茶。
5. 找到合适的光学设备
最后但并非最不重要的一点是,只有在所有光学系统都得到很好的优化后,才能捕捉到图像中的精细细节。如果您从事摄影,您可能会意识到高端镜头通常比相机(例如传感器系统)本身更昂贵。这仅仅是因为在精密玻璃和涂层的开发上花费了如此多的资源和如此多的时间。可以说,这些镜头的质量决定了图像的质量。同样的理论也适用于微观系统。显微镜的光学系统是最终图像质量的关键决定因素。有趣的事实:这是显微镜制造商为了提升他们的技术而激烈竞争的组件!
现在我能听到你说,“我们不能改变显微镜的光学系统。”实际上,您可以更改某些东西,这将极大地影响成像结果,而与您的技术设备无关:用于培养或放置细胞和样品的盖玻片或成像室!这些由薄玻璃或塑料制成的组件对人眼是完全透明的,但它们中的每一个:光/激光通过的地方,都会显着影响最终的成像结果,就像它们是光学系统的一部分一样。
这就是 ibidi µ-Slides 发挥作用的地方! ibidi µ-Slide 腔室和盖玻片的开发具有出色的光学质量,适用于高分辨率显微镜,因为它们的盖玻片底部很薄。对于细胞的标准高分辨率成像(例如,相差、共焦或 2 光子),强烈建议使用细胞培养处理 (ibiTreat) polymer版,其 No. 1.5盖玻片厚度为 180 µm,而 µ-Slides #1.5H 玻璃底部 (170 µm +/-5 µm) 的载玻片非常适合 TIRF 和超分辨率显微镜应用。
在我的博士项目开始时,ibidi µ-Slides被介绍给了我,从那时起我就一直在使用它们进行 IF 实验。如果您以前从未使用过它们,我建议您尝试一下!
 应用简报:利用安捷伦Seahorse实时细胞能量代谢分析评估 T 细胞的生物
应用简报:利用安捷伦Seahorse实时细胞能量代谢分析评估 T 细胞的生物

 评论
评论