概述
基于 T 细胞的疗法正在迅速发展成为许多癌症的有效一线ZL选择。近年来, FDA 已经批准了几种针对免疫检查点的ZL性抗体和小分子用于临床,以补充和提高T 细胞的靶向性和有效性。这些免疫检查点YZ剂的临床前筛选需要强大的体外肿瘤模型来评估 T 细胞杀伤效率。但是,传统的 2D 肿瘤模型通常缺乏生物学相关性和复杂性来预测体内或临床结果。 3D 生物打印平台以及许多其他 3D 培养方法,提供了在生理上更相关的组织模型中自动筛选各种分子和药物的潜力。在此,在此概念验证研究中,我们描述了小鼠肺癌的同系生物打印肿瘤模型,以在细胞细胞毒性测定中评估免疫检查点YZ剂(PD-1)。在生物印记的肿瘤中观察到 T 细胞浓度依赖性杀伤, 并且添加免疫检查点抗体进一步增强了 T 细胞杀伤效力。有人建议,生物打印的 T 细胞细胞毒性测定法可能使研究人员能够在更有效的转化模型中筛选检查点YZ剂。
引言
T 淋巴细胞(T 细胞)在实现对传染病和癌症的长期免疫中起着至关重要的作用。 T 细胞可以在感染或癌细胞表面上的主要组织相容性复合物(MHC)分子的背景下识别特定抗原。这种特异性识别导致 T 细胞分泌有毒颗粒,从而特异性杀死靶细胞。传统上,已经使用在二维(2D)单层中生长的靶细胞进行了 T 细胞杀伤(细胞毒性)测定(Golstein,2018)。这些 2D 分析可通过成像或其他方式快速轻松地进行终点分析。但是,在人体内部,T 细胞介导的靶细胞杀伤发生在三维(3D)环境中,这归因于 T 细胞迁移或渗入 3D 组织核心的其他障碍。因此,3D T 细胞细胞毒性测定法在生理上更相关,并被认为可以更好地预测体内实验的结果。在免疫刺激剂的临床试验中,使用三维肿瘤模型进行细胞毒性试验越来越受到关注。
检查点阻断疗法的ZX发展彻底改变了癌症ZL领域,通过YZ免疫检查点来增强 T 细胞介导的肿瘤细胞杀伤(Topalian,2016)。几种检查点YZ剂,例如抗PD1 和抗 PD-L1 抗体,已被批准用于临床(Sharon,2014 年)。然而,开发高通量 T 细胞毒性测定法以快速和低成本地筛选此类YZ剂的需求仍然没有得到满足。
已经研究了几种 3D 肿瘤模型,包括球状体、悬滴和微流控芯片模型,用于 T 细胞细胞毒性测定。 例如,胶原蛋白-纤维蛋白凝胶用于在 3D 环境中生长癌细胞,以确定杀死所有癌细胞所需的 T 细胞的JD浓度(Budhu,2010)。最近,微流体球体培养用于免疫检查点封锁的体外分析(Jenkins,2018)。 尽管这些模型在模仿体内环境的某些方面显示出希望,但它们通常通量低或无法考虑细胞外基质(ECM)在肿瘤生物学中的关键作用。
生物打印是一项新兴技术,使研究人员能够自动化制造肿瘤构建体以筛选抗ai药或免疫刺激剂。该技术沉积了一种充满细胞的 ECM 材料(通常称为生物墨水),与肿瘤细胞混合,随后进行化学或热固化,从而为打印结构提供机械强度。在这里,我们探索了3D T 细胞细胞毒性测定法的生物打印技术的潜力,以帮助评估免疫检查点YZ剂。
材料和方法
细胞准备
为该项目选择了小鼠肺癌细胞系(LLC-1)和同型 OT-1T 细胞。两种细胞类型均在C57BL/6 背景中。 Lewis 肺癌细胞(LLC-1)从美国典型培养物保藏ZX(ATCC)获得,并根据建议的方案进行培养,每 3 至 4 天传代一次。 为了促进活肿瘤细胞的成像,将编码红色荧光蛋白(RFP)的质粒引入 LLC-1 细胞,以生成稳定的 LLC-RFP 细胞。LLC-RFP 细胞(此后称为“LLC-1”)用于其余实验。按照先前发布的方案(Nath,2016 年),使用 0.75µg / mL SIINFEKL(Ova)肽(New England Peptide)培养 OT-1 脾细胞并将其灌注 5 天。 在第 5 天的共培养研究中,未经进一步纯化就使用了引发的细胞毒性 T 淋巴细胞(CTL)。
生物墨水的制备和生物打印
中和胶原蛋白 I(CELLINK),并与每毫升胶原蛋白中的 106LLC-1 细胞混合。将所有组件(包括注射器,针头和针尖)置于冰上,直至准备使用。将温度控制的打印头(TCPH)设置为 8°C,而将打印床设置为 10°C。使用 BIO X(软件版本 1.8)上的液滴功能在 96 孔板(n= 3)中对三维 LLC-1 肿瘤进行生物打印(见图 1)。印刷后,将 96 孔板转移到 37°C 的恒温培养箱中 20 分钟,以使胶原蛋白聚合。接下来,将 200 µL DMEM 培养基添加到每个孔中。 媒体每 3 天刷新一次。 肿瘤生长 5 天,然后与 T 细胞共培养。

图 1. 肿瘤的三维(3D)生物打印。 使用 BIO X 的液滴打印功能,用胶原蛋白对 Lewis 肺癌细胞(LLC-1)进行胶原蛋白印刷。将胶原蛋白液滴(肿瘤)热固化并在 DMEM 培养基中保持 5 天,然后再与 T 细胞共培养。
在第 4 天,将打印的肿瘤与 1 µg/ mL 的 SIINFEKL 肽孵育 24 小时,以使肿瘤细胞表达相关抗原。 在第 5 天, 洗涤打印的肿瘤, 并以不同的效应子与靶标( E∶T) 比
(0∶5)与 T 细胞共培养 48 小时。对于阳性对照,将肿瘤与依托泊苷或 TNFα孵育以诱导细胞凋亡引起的细胞死亡。 阴性对照孔未接受任何 T 细胞或凋亡诱导剂。对于抗原特异性,少数(n = 8)孔中的肿瘤未用 SIINFEKL ZL,但接受了引发的 T 细胞。为了进行免疫检查点分析, 将引发的 T 细胞用 1μg/mL 的抗 PD-1 抗体( 克隆RMP1-14,InVivoMab)预处理 1 小时,然后将其加入与肿瘤的共培养物中(n = 8)。保留 IgG 同种型对照用于比较。
影像和统计
如先前所述(Steff,2001;Strebel,2001),RFP 荧光的损失被用作肿瘤细胞死亡的读数。 使用 EVOS Auto 2 荧光显微镜进行成像。 使用 ImageJ 软件(NIH)测量荧光强度,并使用 Graphpad Prism 8 进行图形翻译和制备。通过使用学生的 t 检验在 Prism 中对统计结果进行统计,数据表示为平均值±SEM。
结果与讨论
肿瘤细胞生长和球状体形成
BIO X 上的液滴功能能够自动将稳定的胶原蛋白肿瘤液滴分配到 96 孔板中。 液滴形状和孔位置的均匀性有助于整个显微镜和分析工作流程。 对打印的肿瘤进行 RFP 荧光成像,并用 Calcein AM 染色以确定细胞活力。 图 2 中显示的结果表明,LLC-1 细胞在第5 天在打印的肿瘤中是可行的。此外,这些细胞被限制在胶原蛋白内,而不是逃逸其结构以在 2D 表面上生长。
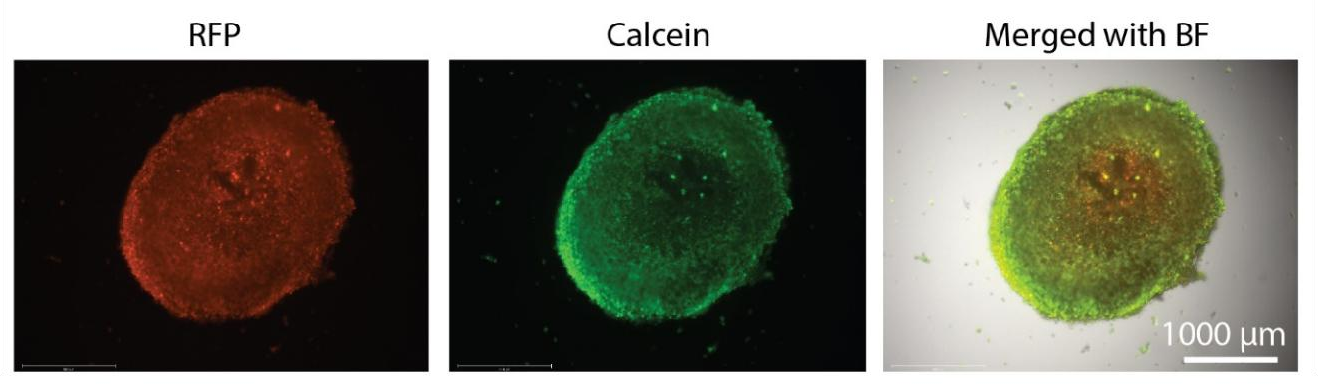
图 2. 肿瘤细胞的生长和生存力。 对打印的肿瘤进行 RFP 荧光成像,并用钙黄绿素 AM 染色以确定 T 细胞筛选前第 5 天的细胞活力。
3D 中的 T 细胞细胞毒性测定
T 细胞介导的细胞毒性被定量和定性验证。 当将肿瘤与 T 细胞共培养时,观察到肿瘤细胞活力的 T 细胞浓度依赖性降低(见图 3A)。 在 5:1(E:T)的比率(代表 106 CTL/孔)下,与无 CTL 对照相比,观察到了肿瘤生存力的统计学显着降低(p=0.0003)(〜30%)。 在存在或不存在 T 细胞的情况下,打印肿瘤的代表性图像显示在图 3B中,当在共培养物中存在 T 细胞时,RFP 荧光显示出质的下降。T 细胞能够附着在胶原屏障上并在 3D ECM 环境中与癌细胞相互作用。
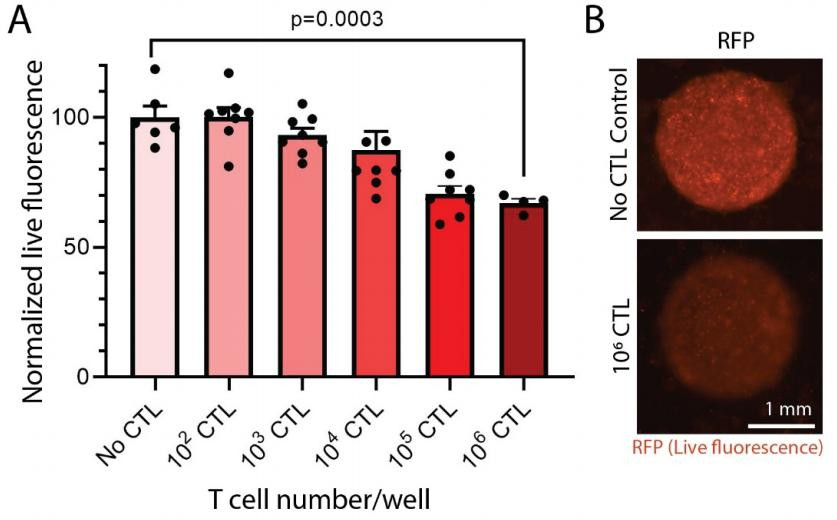
图 3. 在第 5 天使用 3D 生物打印的肿瘤模型进行 T 细胞细胞毒性测定。(A)观察到 T 细胞浓度依赖性地降低了肿瘤细胞的活力,这是通过 RFP 荧光的丧失来确定的。 CTL 的数量代表每孔的总 CTL。 (B)显示了在存在或不存在 T 细胞的情况下打印的肿瘤的代表性图像。 使用相同的采集参数拍摄图像。
免疫检查点测定
为了扩大 T 细胞杀伤的效用或限制,将肿瘤与经抗 PD1 抗体预处理的初免 T 细胞以 5:1 的 E:T 比例共培养。如图 4 所示,与同种型对照相比,使用抗 PD1 抗体阻断 PD-1 / PD-L1 轴显示出 T 细胞介导的肿瘤细胞杀伤的增加(p=0.0039)。 因此,由于 PD-1 检查点的阻滞,引发的 T 细胞能够更有效地附着在胶原蛋白屏障上, 更有效地浸润和杀死肿瘤细胞。
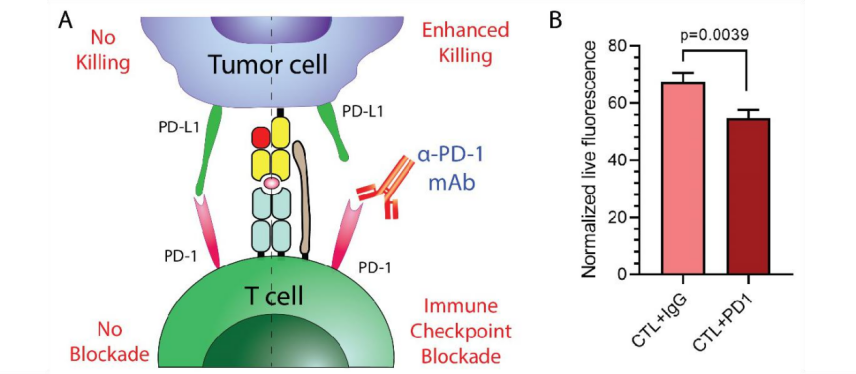
图 4. 免疫检查 (A)显示了免疫检查点阻断测定的示意图。 单克隆抗 PD1 抗体阻断了 PD1 与 PD-L1 之间的相互作用,从而增强了 T 细胞对肿瘤细胞的杀伤力。(B)在 IgG 同种型对照或抗 PD1 抗体存在下,将 3D 生物打印的肿瘤细胞与初免化的 T 细胞以 5:1 的 E:T 比例共培养。 PD1 阻断显示出对靶细胞的增强杀伤作用。
结论
v 3D 生物打印技术可用于 T 细胞细胞毒性测定中,以用胶原蛋白打印 RFP 标记的鼠类肺癌细胞。
v 生物打印的肿瘤细胞在胶原蛋白基质内仍然被限制和存活。 观察到 T 细胞浓度依赖性的细胞毒性增加。
v 如文献所述,抗 PD-1 抗体的使用增强了 T 细胞介导的杀伤效率。
v T 细胞细胞毒性测定与高含量成像工作流程兼容,还可以适应其他肿瘤模型,包括患者来源的异种移植,以加快药物筛选过程并推动个性化药物的临床转化。
v 进一步的研究可能包括通过生物打印的肿瘤细胞对抗原呈递的定量,肿瘤中 T 细胞的浸润以及 T 细胞表达的细胞因子。
v 此外,BIO X 上的多孔生物打印格式可用于扩大对生物试剂(例如免疫检查点YZ剂)和工程 T 细胞(CAR-T)的高通量筛选的支持。
参考文献
1. Budhu, S., Loike, J. D., Pandolfi, A. CD8+ T cell concentration determines their efficiency in killing cognate antigen-expressing syngeneic mammalian cells in vitro and in mouse tissues. Journal of Experimental Medicine. 2010; 207(1): 223–235. DOI: 10.1084/jem.20091279.
2. Golstein, P. and Griffiths, G. M. An early history of T cell-mediated cytotoxicity. Nature Reviews Immunology. 2018; 18(8): 527–535. DOI: 10.1038/s41577-018-0009-3.
3. Jenkins, R. W., Aref, A. R., Lizotte, P. H., et al. Ex vivo profiling of PD-1 blockade using organotypic tumor spheroids. Cancer Discovery. 2018; 8(2): 196–215. DOI: 10.1158/2159-8290.CD-17-0833.
4. Nath, S., Christian, L., Tan, S. Y., et al. Dynein seperately partners with NDE1 and dynactin to orchestrate T cell focused secretion. Journal of Immunology. 2016; 197(6): 2090–2101. DOI:10.4049/jimmunol.1600180.
5. Sharon, E., Streicher, H., Goncalves, P., and Chen, H. X. Immune checkpoint inhibitors in clinical trials. Chinese Journal of Cancer. 2014; 33(9): 434–444. DOI: 10.5732/cjc.014.10122.
6. Steff, A.-M., Fortin, M., Arguin, C., and Hugo, P. Detection of a decrease in green fluorescent protein fluorescence for the monitoring of cell death: An assay amenable to high-throughput screening technologies. Cytometry. 2001; 45(4): 237–243. DOI: 10.1002/1097-0320(20011201)45:4<237::AIDCYTO10024>3.0.CO;2-J.
7. Strebel, A., Harr, T., Bachmann, F., et al. Green fluorescent protein as a novel tool to measure apoptosis and necrosis. Cytometry. 2001; 43(2): 126–133. DOI: 10.1002/1097-0320(20010201)43:2<126::AID
CYTO1027>3.0.CO;2-J.
8. Topalian, S., Taube, J., Anders, R. et al. Mechanism-driven biomarkers to guide immune checkpoint blockade in cancer therapy. Nature Reviews Cancer. 2016; 16(5): 275–287. DOI: 10.1038/nrc.2016.36.
 挤出与DLP 3D生物打印—比较说明
挤出与DLP 3D生物打印—比较说明
 三维生物打印技术在离体自然杀伤细胞检测中的应用 宫颈癌肿瘤模型
三维生物打印技术在离体自然杀伤细胞检测中的应用 宫颈癌肿瘤模型
 肿瘤免疫与肿瘤微环境研讨会
肿瘤免疫与肿瘤微环境研讨会
 创新服务科学——新芝生物多款重磅新品BECIA首秀
创新服务科学——新芝生物多款重磅新品BECIA首秀

 评论
评论