灵敏的检测 - 蛋白质和多肽反相HPLC分析和纯化指南
利用反相GX液相色谱法分离多肽时,通常通过在214-215 nm波长附近的紫外吸收检测。
肽键在这一波长范围内吸收较好,为各类型多肽提供Z灵敏的检测。
采用短波紫外波段检测的一个问题是流动相的吸收。
在波长215 nm处,乙腈不吸收紫外光,但TFA会略有吸收。
在梯度洗脱期间,增加有机溶剂的浓度会使溶液的介电常数发生改变,这将引起TFA在短波紫外波段吸收光谱的变化。
这一吸光度变化会导致基线上飘,如图21所示。在需要灵敏检测时尤其明显。
在示例中,多肽图谱经常显示出基线飘高(图22)。避免基线漂移的常见做法是降低有机溶剂中TFA的浓度(相对于水溶性溶剂)。
如果在水溶性溶剂中加入0.1%的TFA,则在有机溶剂中加入0.08-0.09%的TFA。这将使多肽图谱中的基线趋平。
图21. 梯度洗脱期间,增加乙腈的浓度会改变流动相的介电常数,从而由于TFA吸收光谱的变化导致基线飘高。
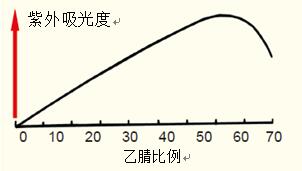
图22. 随着有机溶剂浓度的增加,TFA吸收率变化可能引起多肽图谱中基线的漂移。
温度的影响 - 蛋白质和多肽反相HPLC分析和纯化指南
柱温和流动相温度会以两种方式影响多肽的分离。
随着温度上升,保留值会略微降低。
但更重要的是,肽对的相对保留值(选择性)取决于温度。
选择性随温度的变化影响分辨率,且在一系列多肽分离的优化中,温度是重要因素,如蛋白酶水解蛋白质期间产生的多肽。
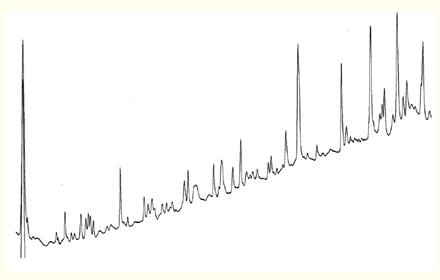
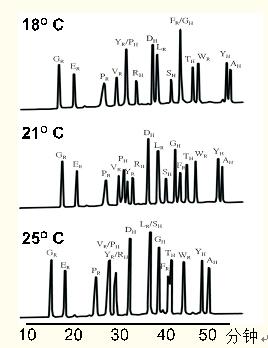
温度在一系列合成肽分离中的作用如图23所示。
随着温度的增加,多肽保留值略有下降,但更重要的是,肽对间的分辨率随着温度的变化而变化。
因此,在多肽的分离中,控制柱温和流动相温度很重要。
此外,温度还是肽分离优化的重要变量,尤其是肽图谱中的分离。
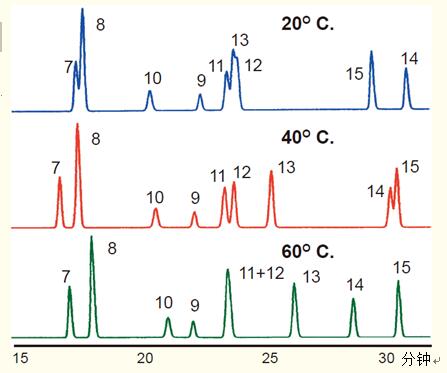
温度会显着影响肽图谱中多肽的分离,如图24所示。
该示例为从人生长激素的胰蛋白酶水解物中分离多肽,增加柱温不仅影响肽的选择性,还会造成洗脱顺序的逆转。肽7和8在较高温度下的分辨率更高。
肽11~13的Z佳分离温度为40°C,温度提升至60℃会出现肽11和12的共洗脱峰。
肽14和15的Z适分离温度为20°C,肽15先出峰。
温度升至40℃时会使肽14先于肽15洗脱。
温度升至60℃时会提高肽14和15的分辨率。
在肽图谱中可以明显看出柱温对分辨率有显着的影响。
图23. 多肽保留值随着温度的增加而降低。更重要的是,温度影响相对保留值或选择性,进而影响分辨率。
条件
色谱柱:C8,2.1 x 150 mm
流动相:0~30% 乙腈—0.05% TFA体系,梯度洗脱,60分钟。
样品:合成螺旋多肽和非螺旋多肽
图24. 通常,蛋白水解产生多肽的相对保留值会受到温度的影响。
条件
色谱柱:C8宽孔柱,4.6 x 150 mm
流动相:0~60% 乙腈—0.1% TFA体系,混合梯度洗脱,60分钟。
样品:人生长激素的胰蛋白酶水解物
与多肽分辨率相比,蛋白质分辨率受温度的影响较小,但温度较高时,蛋白质的峰形和回收率均有所改善,特别是大分子蛋白或疏水性蛋白。
在环境温度下,单克隆抗体图谱的峰形较差,但当温度升高时,峰形会有明显改善(图25)。
通常在高温下用色谱法分析大分子蛋白或疏水性蛋白的效果Z佳。
图25.温度对反相GX液相色谱法(RP-HPLC)分析重组单克隆抗体的影响。
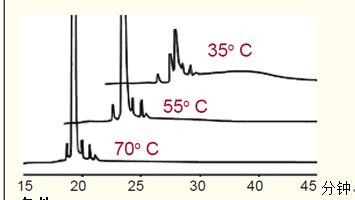
条件
色样品:重组单克隆抗体
谱柱:C8 宽孔柱,3.5 微米,4.6 x 150 mm
流动相:混合液梯度洗脱:20-90% 乙腈-0.1% TFA体系

 评论
评论