肽图分析法 - 蛋白质和多肽反相HPLC分析和纯化指南
反相GX液相色谱已成为蛋白质分析和表征的标准方法,尤其是ZL性药物的分析和表征。
反相色谱分析法分辨率高,检测灵敏度好,能够提供大量关于蛋白质的信息。
有些时候,蛋白质作为完整的分子分析,但更多的时候采用蛋白水解酶作用于特殊的氨基酸残基将碳骨架断开,从而将蛋白质裂解成小片段。
随后用反相GX液相色谱法对裂解产生的肽段进行分析。
该技术叫作肽图分析,是一种标准的蛋白质分析方法。
通过反相色谱分析蛋白质裂解后的肽段能够获得蛋白质的大量信息。
通过比较表达蛋白与参照标准蛋白的肽图能够得出蛋白纯度和表达的准确性。肽图通常作为蛋白质ZL药物的鉴定分析工具。
通过肽图可以确定蛋白质降解产物,如发生脱酰胺作用的天冬酰胺和氧化甲硫氨酸。
肽图可以确认或验证二硫键连接,以此得出蛋白质三级结构和LX。
肽图能够确定糖基化(加入碳水化合物)位点,为详细鉴定连接在其上的寡糖提供了条件。
利用质谱检测得到的肽图为蛋白质鉴定、肽序列分析和数据确认提供了一种先进的手段。
在生物蛋白质组研究中,蛋白酶水解产物还用于蛋白质的鉴定和定量分析。
有许多蛋白水解酶都能断开蛋白质的碳骨架,通常作用于特殊氨基酸残基。包括:
蛋白酶 | 特异性 | 特性 |
胰蛋白酶 | 作用于赖氨酸和精氨酸的羧基端 | 平均每10~12个氨基酸产生一个肽。胰蛋白酶是Z常用的蛋白水解酶。 |
胞内蛋白酶 Lys-C | 作用于赖氨酸的羧基端 | 能够产生胰蛋白酶水解蛋白生成多肽的60~70%。Lys-C 的优点是在高达4M的尿素浓度中仍能保持活性。 |
S.aureus V8 蛋白酶 | 作用于酸性氨基酸和天冬氨酸的羧基端。 | 为胰蛋白酶水解法提供补充信息。 |
胞内蛋白酶 Asp-N | 作用于天冬氨酸的羧基端 | 为胰蛋白酶水解法提供补充信息。 |
胰蛋白酶是Z常用的蛋白水解酶(蛋白酶)。以下为胰蛋白酶水解蛋白的五个阶段:(注:参考文献21详细回顾了胰蛋白酶的水解)
变性。要在合理的时间内完成蛋白质水解,必须对蛋白质作变性处理。高温下(37℃),将蛋白质置于6M 盐酸胍或8M 尿素等离液剂中,在中性pH值(~7.5)缓冲液下处理30分钟,蛋白质即可变性。
二硫键的还原。二硫键会阻止蛋白质的完全变性。
通常可通过在待水解蛋白的变性过程中加入浓度为~20 mM 的二硫苏糖醇(DTT)等还原剂将二硫键还原。
游离半胱氨酸的羧甲基化。如果还原性半胱氨酸保持游离状态,则有可能以错误的方式重新形成二硫键。
为了避免这种情况,可加入浓度为~60mM的碘乙酸等试剂,在37℃温度下处理30分钟,使游离半胱氨酸甲基化。该反应由100 mM DTT 退火。
脱盐。当溶液中存在尿素或胍盐时,水解反应无法进行,因为胰蛋白酶自身作为一种蛋白质会变性,失去酶活性。
尿素或胍盐必须通过离子交换或渗析去除或将浓度降低至1M以下。
胰蛋白酶水解。脱盐后,将蛋白质溶解在pH7.5~8.5(胰蛋白酶的Z高活性pH)的缓冲液中——Tris或碳酸铵,并在20~100个待水解蛋白组分中加入一份胰蛋白酶,随后在低温至37℃的温度区间内处理蛋白质。
低温处理时间长达16个小时。在37℃下,水解可在1~4小时内完成,具体取决于蛋白质。
如果胰蛋白酶的时间、温度或相对浓度均过低,则水解将不完全,一些潜在裂解可能不发生,Z终导致形成含赖氨酸或精氨酸的大分子肽。
如果胰蛋白酶的水解时间、温度或浓度均过高,则会发生胰蛋白酶自身溶解,产生“自溶产物”,即胰蛋白酶水解产生的肽段,从而造成混淆。
惯常的做法是忽略蛋白质,考虑胰蛋白酶。按照蛋白质完全水解的条件对得到的样品进行色谱分析,了解胰蛋白酶自溶的程度以及肽图中任何胰蛋白酶自溶肽产物的位置。
开发胰蛋白酶水解协议过程中,对胰蛋白酶和蛋白质的水解时间、温度和相对浓度进行了优化。
当利用肽图确定二硫键的位置时,必须在不还原二硫键的情况下水解蛋白。但在二硫键未被还原的情况下,许多蛋白质的水解速度非常慢。
在缺还原剂的情况下,如果水解速度很慢或水解不佳,可利用Lys-C代替胰蛋白酶,并在4M尿素中水解,维持水解过程中蛋白质的变性。
水解过程中有时采用表面活性剂维持溶液中的蛋白质,但表面活性剂会降低色谱分辨率,应尽量避免。
胰蛋白酶水解分析。蛋白质水解产生的肽段利用反相GX液相色谱分析,流动相采用含TFA体系(参见第15-17页),以起始浓度约5%的乙腈梯度洗脱(乙腈起始浓度低于5%可能导致较早洗脱出肽的色谱的不可重现性),乙腈浓度逐渐升至70%(参见图31)。
梯度洗脱的时间取决于待水解蛋白的大小。
大分子蛋白比小分子蛋白水解产生更多的肽段,因此肽段的分离需要更长洗脱时间。
小分子蛋白(小于20kd)水解产生的肽通常可在45~60分钟内完成分离。
大分子蛋白(20-50kd)需要较长的洗脱时间,一般为60~120分钟。
分子量大于50kd的蛋白质需要120~180分钟的洗脱时间。
采用1~2 ml/min 的流速和适宜的温度时分辨率Z佳。
通常采用C18 反相柱。可以使用孔径为100埃或300埃的柱子,其选择性通常不同。
图31. 牛血清白蛋白的肽图
色谱柱:ACE 5 C18-300 宽孔柱,4.6 x 150 mm
流动相:4%~70%乙腈-0.1% TFA 体系,混合梯度洗脱120分钟。

蛋白质修饰引起肽保留时间的变化。如果蛋白质因翻译或表达错误,降解(脱酰胺作用、氧化反应)或过程变异而改变,则这种改变将会反映在一种或多种肽段。
由于与肽的反相相互作用的灵敏度,肽的任何变化都将导致该肽保留时间的变化。
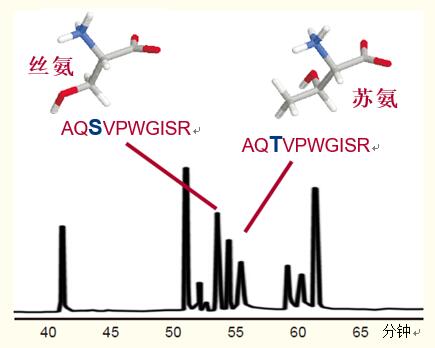
在图32示例中,相差一个氨基酸的两种十肽,其中一个为苏氨酸,另一个为丝氨酸,在反相HPLC图谱中出现了两个峰。
不仅仅是一个氨基酸的差别,而且两种氨基酸均为羟基氨基酸,它们的不同之处在于苏氨酸侧链上加了一个甲基。
这说明了蛋白质的任何变化都会反映为肽的变化,从而导致该肽保留时间的改变。
肽图分析的本质是反相HPLC能够实现差别细微的多肽的分离。
图32. 以RP-HPLC对紧密关联的肽类进行分离。
仅有一个氨基酸不同的两种十肽菌素,一种含丝氨酸,而另一种含苏氨酸。
条件
色谱柱:C18 宽孔柱, 4.6 x 250 毫米
洗脱液:
A. 含有0.1%三氟乙酸的水溶液
B. 含有0.08%三氟乙酸的乙腈溶液
梯度:0 - 35%的B溶液超过73分钟
试样肽图与参照蛋白质肽图的比较。肽图能够提供有关蛋白质的很多信息。
惯常做法是对试样的肽图和参照蛋白质的肽图进行比较。
图33对重组人生长激素(在大肠杆菌中表达)的肽图和天然人生长激素(缺乏甲硫氨酸)的肽图进行了比较。
由于甲硫氨酸的疏水性质,重组人生长激素比天然人生长激素较晚洗脱出来。
在这个例子中,为了便于比较,将第二幅图谱倒置显示。
在一些情况下,为了确认微小的变化和证明分析工具与肽图的变化无关,会将两种水解产物混合进行色谱分析。
肽图比较揭示了蛋白质的改变和修饰,如:基因改变、翻译错误、蛋白降解(脱酰胺作用、氧化反应),以及翻译后修饰的改变。
图33. 重组人生长激素和天然人生长激素(缺乏甲硫氨酸)肽图的比较。
条件:
色谱柱:C18宽孔柱,4.6 x 150 mm
流动相:0~70% 乙腈-0.1% TFA 体系梯度洗脱


 评论
评论