近年来,免疫细胞疗法无疑是癌症治疗领域最热门的方向之一。无论是已经展现惊人疗效、获批上市的CAR-T疗法,还是在实体瘤领域颇有潜力的NK细胞疗法,都吸引了不少公司投入研发。据Nature相关统计,截至2022年4月5日,全 球肿瘤免疫治疗管线中有2756种细胞治疗药物,其中CAR-T疗法占比50%以上,管线数量位居前列的其他几种免疫细胞疗法分别是TCR-T、NK以及TIL疗法。这几种细胞疗法各具优势,当然也各有目前尚未解决的副作用或局限性。
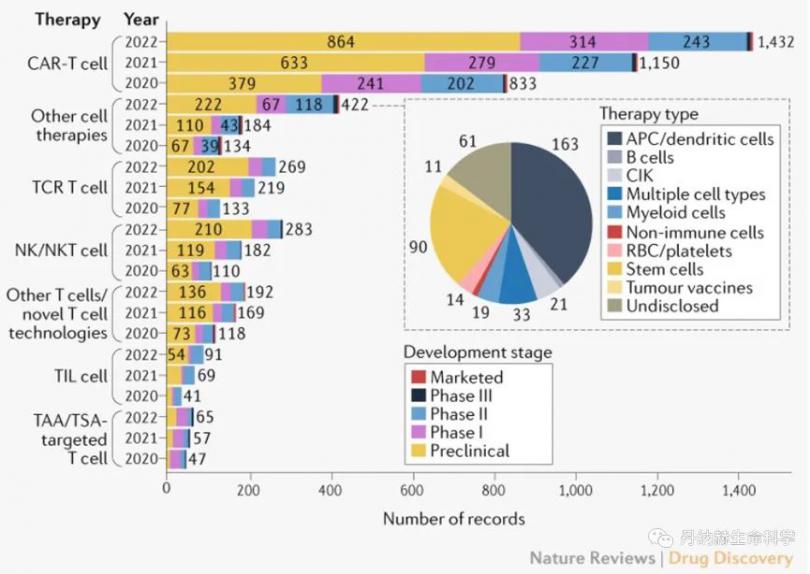
细胞疗法临床试验情况
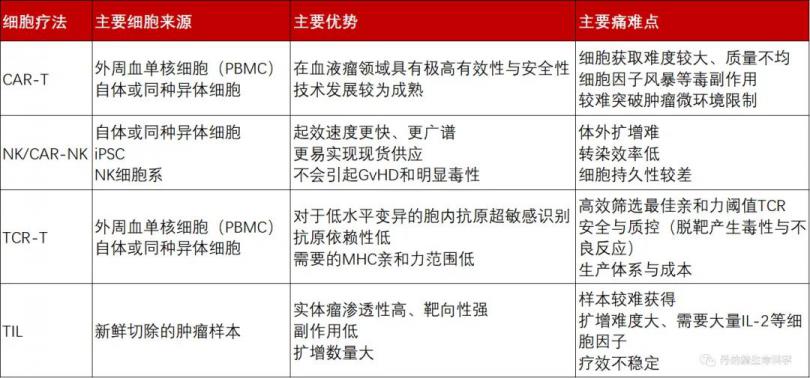
四大细胞疗法
CAR-T是唯 一一种有产品获批上市的免疫细胞疗法,在这一领域独占鳌头,这种疗法通过对T细胞进行基因改造,导入能编码识别肿瘤特异性抗原的受体基因实现精 准地靶向杀伤。CAR-T细胞获取难度较大,需要均一、高质量的细胞产品来保障疗效,同时还面临着副作用、毒性、T细胞耗竭和恶性肿瘤微环境(TME)等挑战,此外,自体CAR-T疗法所需的制备时间长、成本高,异体CAR-T则需要解决免疫排斥反应。
NK细胞能对病毒感染、转化的细胞产生多种效应器功能,虽然目前CAR-NK相关的研究仍处在起步阶段,但临床前以及临床研究的数量正逐年增加。相较于CAR-T疗法,NK细胞天然具备了异体治疗的优势,并且没有细胞因子综合症等副作用,来源更加多样。但是,CAR-NK同样面临着一定挑战,包括体外扩增转染难度较大、缺乏体内持久性、归巢不稳定、TME的免疫抑制以及CAR结构的优化等。
TCR-T疗法同样是对T细胞进行基因改造,但TCR-T疗法是基因改造、筛选和鉴定能够特异性结合选择靶点抗原的TCR序列,通过基因工程手段将其转入到T细胞中,在实体瘤治疗领域具有更大的潜力。TCR-T与CAR-T的主要区别在于T细胞识别抗原时是否需要MHC参与,TCR-T潜在靶点范围更大,但亲和力可能更低,目前面临着新的安全靶点选择以及筛选HLA配型两大技术难点。
TIL疗法是指从肿瘤组织中分离自然浸润淋巴细胞,在体外扩增,然后重新回输到患者体内,具有多种TCR克隆性、优越的肿瘤归巢能力和较低的靶向毒性,在实体瘤领域具有极大的优势,但这种疗法在应用时有较多限制,具有抗肿瘤活性的TIL细胞来源较窄,并且在体外扩增培养时需要大量外源性细胞因子,可能会带来一定的安全性隐患。
除了上述的四种疗法,免疫细胞疗法还包括DC、CIK、LAK等等,不同细胞疗法也有不同的技术路线,甚至同种细胞的不同产品也会使用不同的研发生产技术。不过,所有的细胞疗法总体的研发路线都是一致的,包括细胞新药发现与创新医疗技术阶段,药学研究阶段,临床前实验阶段,模拟现场合规性检查,新药申报和医疗技术备案,临床研究,生产运输,上市以及药品上市后研究。
从新药发现到临床前需要进行药学研究对药物进行验证,其中的质量研究与质量控制是药学研究中最关键的一环,后续产品的质量也在一定程度上决定着临床试验数据的可靠性,对药物的后续发展起着重要影响。在这一过程中,原材料差异大、效力和安全性评估复杂都是企业要解决的问题。目前,企业可以通过使用高质量、高批次稳定的原材料,严格把控生产工艺和质量标准,采取模块化生产的方式来提升产品的质量控制,也需要高通量细胞观察研究对细胞特性、功能性以及纯度等方面进行分析,对产品质量做出精 3准的判断。
据弗若斯特沙利文预测,从2021年至2023年,中国免疫治疗产品市场规模将由13亿增至102.0亿元,预计2030年免疫治疗产品规模将达584亿元。面对免疫细胞治疗市场的快速扩增,丹纳赫生命科学一系列细胞制备、处理及分析设备以及多样化的自动化、高通量整合方案可以帮助细胞治疗用户应对从研发到质控的各种挑战!

 应用简报:利用安捷伦Seahorse实时细胞能量代谢分析评估 T 细胞的生物
应用简报:利用安捷伦Seahorse实时细胞能量代谢分析评估 T 细胞的生物
 微流控细胞灌注套装-细胞与生物学中的液体处理
微流控细胞灌注套装-细胞与生物学中的液体处理
 珀金埃尔默携全线细胞学方案点亮2020ZG细胞生物学会年会@苏州
珀金埃尔默携全线细胞学方案点亮2020ZG细胞生物学会年会@苏州

 评论
评论