
摘要
自然杀伤(NK)细胞是一种先天免疫细胞,通过发挥细胞毒性作用,在清除转化或癌变细胞方面发挥着重要作用。近年来,一些免疫刺激分子和生物制剂被用来提高NK细胞的溶瘤作用。三维(3D)细胞培养技术已经发展到更好地概括体内结构和生理相关性,以评价这些药物和生物制剂的体外。在这个概念验证研究中, 我们开发了一个三维生物打印的子宫颈癌肿瘤模型,以证明NK细胞的细胞毒活性。用Ⅰ型胶原3D生物打印GFP标记的人宫颈癌细胞SiHa和CaSki,并与人外周血源性NK细胞共培养96h。NK细胞对肿瘤细胞的细胞毒性作用通过荧光显像进行评估,显示在NK细胞浓度增加的情况下,肿瘤杀伤程度更高。本文描述的方法是可缩放的,与高含量成像兼容,并且容易翻译到其他肿瘤模型。
介绍
自然杀伤(NK)细胞是先天免疫系统中的一种细胞毒性效应细胞,利用一系列预先确定的种系编码受体来感知病原体和转化细胞,包括肿瘤细胞。与细胞毒性T淋巴细胞不同,NK细胞不需要肿瘤抗原特异性激活, 而是在肿瘤细胞表面寻找“缺失的自我”受体,如MHC I类分子。NK细胞的溶细胞活性是由细胞表面受体传递激活或抑制信号的相对平衡调节的。在正常生理条件下,健康细胞表面的MHC I类分子与NK细胞上的抑制受体相互作用,而与此同时,与NK细胞上的激活受体相互作用的激活配体较少(图1)。然而,抑制信 号超过激活信号,导致自我耐受(Long,2013)。肿瘤细胞倾向于下调MHC I类分子以逃避T细胞介导的杀伤,从而变得容易发生NK细胞介导的细胞毒性(Garrido,2016)。自然杀伤细胞的传统特征是存在CD56细胞表面标记物,而缺乏CD3。此外,CD16对NK细胞的功能也很重要,因为CD16能诱导细胞因子的表达和细胞毒效应物的活性。
NK细胞向实体瘤的浸润在许多癌症适应症中与更好的预后相关,包括非小细胞肺癌、结直肠癌和宫颈癌(Burke,2010)。这些肿瘤组织的细胞和细胞外基质(ECM)的组成被认为在NK细胞的细胞毒和浸润功能中起着至关重要的作用,这些功能在体外模型研究中往往具有挑战性。
研究了几种三维肿瘤模型, 包括球体、悬吊液滴和微流控芯片模型,用于NK细胞毒性试验。例如, Giannattasio(2015)报道了一个子宫颈癌的球体模型来研究离体NK细胞杀伤效率。他(2014)使用旋转细胞 培养系统产生大量均匀的球体用于NK细胞杀伤试验。虽然这些模型模拟了体内环境的某些方面和一定程度的穿透,但它们中的许多没有考虑ECM在肿瘤生物学中的关键作用。
3D生物打印是一项新兴技术,它使研究人员能够自动化地制造肿瘤结构,以筛选抗ai药物或免疫刺激剂。该技术分配一种细胞负载的ECM材料,或生物墨水,与肿瘤细胞混合,随后化学或热固化,以提供印刷结构的机械强度。
在此,我们探索三维生物打印技术在NK细胞毒性分析中的潜力,以帮助评价离体NK细胞的细胞毒性。用Ⅰ 型胶原3D生物印迹GFP标记的人宫颈癌细胞SiHa和CaSki,并与人外周血源性NK细胞共培养。NK细胞对肿瘤细胞的细胞毒性效应用荧光成像进行评估,显示在NK细胞浓度增加的情况下,肿瘤杀伤程度更高。这里描述的方法是可扩展的,与高含量成像兼容,并容易翻译到其他肿瘤模型。
材料和方法
细胞及细胞系制备
人宫颈癌细胞株SiHa(ATCC HTB-35) 和CaSki(ATCC CRL-1550) 来源于ATCC。SiHa和CaSki细胞分别在EMEM和RPMI-1640培养基中,添加10%热灭活FBS和1%PEN/STREP溶液。SiHa和CaSki细胞是用GFP编码的慢病毒转导的(Kercher,2020)。转导后72小时,用FACSaria(BD Biosciences)细胞分选器对稳定的GFP 表达细胞进行分选。取健康供者外周血原代人NK细胞(2W-501,Lonza),阴性选择,冷冻保存。将NK细胞解冻后在LGM-3淋巴细胞生长培养基(Lonza,CC-3211)中培养,并加入500U/ml人重组IL-2(PeproTech,200- 02)。所有细胞均在含5%CO2的加湿培养箱中保持在37℃。
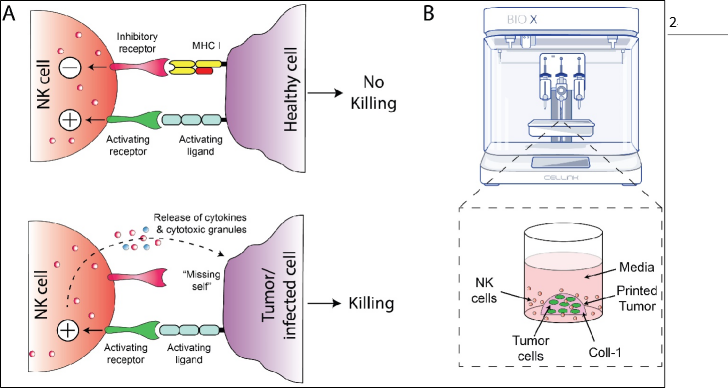
图1.三维生物打印NK细胞毒性试验。(A)NK细胞介导的细胞毒性机制:NK细胞在肿瘤细胞表面寻找“缺失的自身”受体,如MHC一类分子。NK细胞的溶细胞活性是由细胞表面受体传递激活或抑制信号的相 对平衡调节的。(B)宫颈肿瘤的3D生物打印。利用BIO X的液滴打印功能对SiHa和CaSki细胞进行生物打印,将胶原液滴(肿瘤模型)热凝并在培养液中维持4d后与NK细胞共培养。
生物墨水的制备与生物打印
胶原I(Coll-1,CELLINK)被中和,并按照制造商的说明与每毫升胶原1×106 SiHa或CaSki细胞混合。所有部件,包括注射器、针头和针尖都放在冰上,直到准备使用。温度控制打印头(TCPH)被设置为8°C,被打印的 被设置为10°C。在96孔板(n=3)中使用BIO X(软件版本1.8)上的液滴功能分配~8μL细胞-胶原悬浮液(见图1b)进行三维(3D)SiHa或CaSki肿瘤的生物打印(见图1b)。1毫升细胞-胶原悬浮液的总体积足以在96孔板中打印肿瘤液滴。印刷后,将96孔板转移到37°C加湿培养箱中20分钟,以允许胶原聚合。接下来,在每个井中添加200μL的EMEM(SiHa)或RPMI-1640(CaSki)介质。媒体每2天刷新一次。在第5天与NK细胞共培养前,培养4天。第4天,一些样品用Alexa面粉647结合的鬼笔苷染色肌动蛋白。
3D共培养试验
第5天,冲洗打印出来的肿瘤,在200μL的LGM-3生长培养基中,在IL-2存在下,以不同效应靶比(E:T)
(0-20)与NK细胞共培养72小时。阳性对照组分别与足叶乙甙或TNFα孵育,诱导细胞凋亡。阴性对照组未接受任何NK细胞或凋亡诱导剂。
成像与统计
在试验结束时,打印出来的肿瘤在显像前用碘化丙啶(PI)染色10分钟。PI用DPBS洗涤两次,去除松散粘附/ 死亡的NK细胞。GFP荧光的丢失和PI信号的升高被用作先前描述的肿瘤细胞死亡的读出(Kercher,2020)。成像是用连接到单色相机的表荧光显微镜进行的。用美国国立卫生研究院ImageJ软件测量荧光强度,用GraphPad棱镜8翻译并制作图形。结果用学生t检验在棱镜上进行统计学测量,数据用均值±SEM表示。
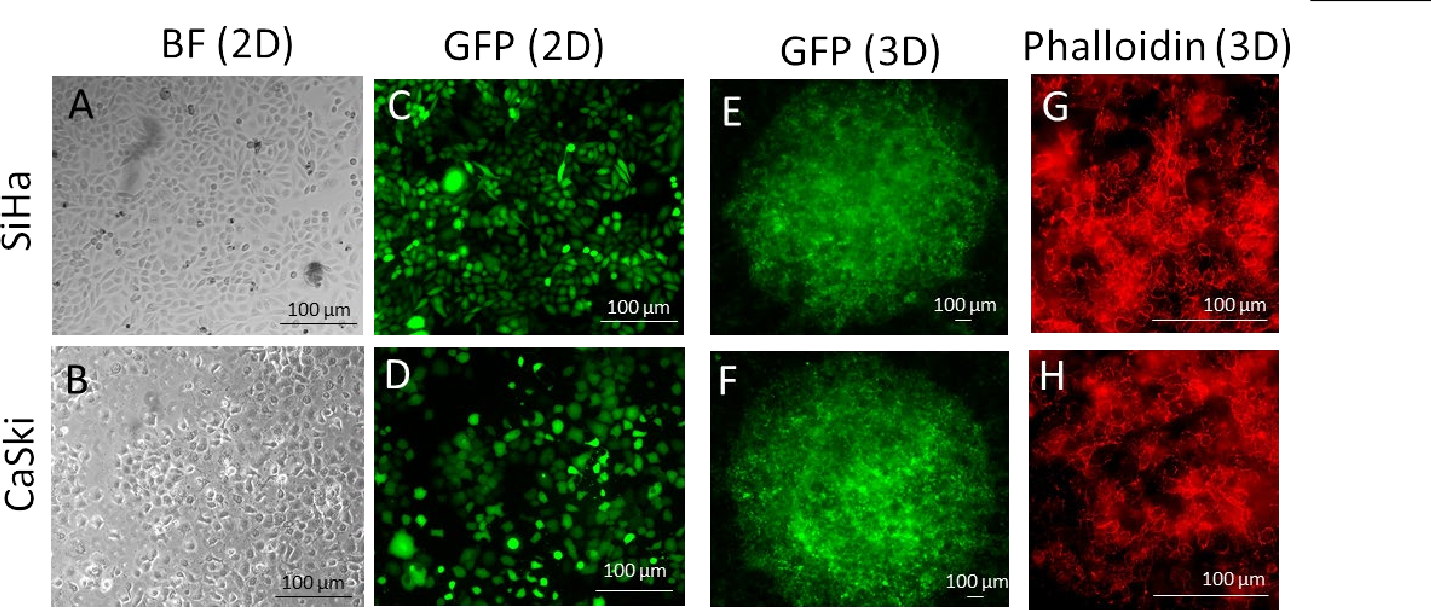
图2.用慢病毒转导人宫颈癌SiHa和CaSki细胞表达GFP。(A-D)SiHa和CaSki细胞在二维单层上生长, 用亮场(BF)和GFP通道成像。(E-F)GFP表达细胞与I型胶原和3D型胶原混合,在96孔板中进行生物打印。3D结构的图像在第4天被捕获。(G-H)第4天,肿瘤标本用Alexa面粉647-结合鬼笔苷染色。刻度条=100μm。
结果和讨论
肿瘤细胞生长与生物标记肿瘤形成
BIO X上的液滴功能能够自动在96孔板中分配一致的胶原-肿瘤液滴。液滴形状的均匀性和良好的放置有助于整个显微镜和分析工作流程。3d生物打印的肿瘤液滴进行GFP荧光成像,并用PI染色测定 细胞活力。图2所示的结果表明,在第4天,宫颈癌细胞在打印的肿瘤中是可行的。Phalloidin染色
(图2G-H)显示三维生物打印肿瘤内细胞周围有特征性肌动蛋白积累。
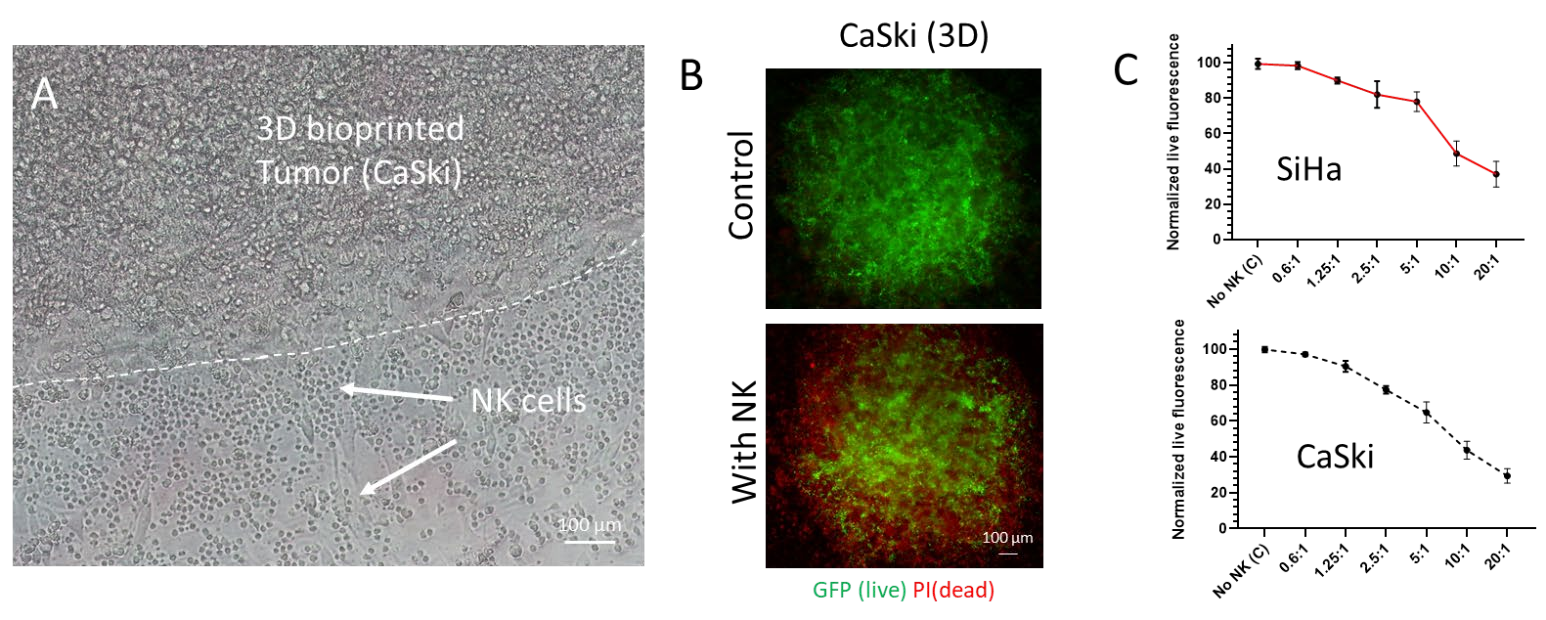
图 3. 3D 中的NK 细胞细胞毒性测定。 (A) CaSki 细胞经过 3D 生物打印并与NK 细胞共培养。 明场图像显示打印肿瘤周围浸润的 NK 细胞。 (B) 在共培养结束时,生物打印的肿瘤被 PI 染色,用 GFP 和 PI 通道捕获图像并使用ImageJ 合并。(C) 一系列E:T 比率(0 到 20) 用于共培养。 SiHa(顶部)和CaSki(底部) 细胞的生物打印肿瘤模型均显示出肿瘤细胞活力的NK 细胞剂量依赖性降低。 比例尺= 100 µm。
肿瘤与NK共培养及细胞毒性分析
对NK细胞介导的细胞毒性进行了定性和定量验证。共培养的亮场图像显示了SiHa和CaSki细胞类型的肿瘤与NK细胞的相互作用(图3A)。在荧光成像和定量后,观察到NK细胞浓度依赖性的肿瘤细胞 存活率下降。在20:1(E:T)比下,观察到与no NK对照组相比,肿瘤存活率降低(~60%-70%)有统计学意义(P=0.0003)。图3显示了有无NK细胞的印刷肿瘤SiHa和CaSki的代表性图像,当NK细胞存在于共培养中时,GFP荧光质量下降。最有趣的是,在NK细胞存在的情况下,打印肿瘤的外周显示GFP荧光的最大减少(图4),表明NK细胞浸润到打印肿瘤的胶原基质中。然而,对NK细胞进行特异性染 色是确认NK细胞浸润程度所必需的。
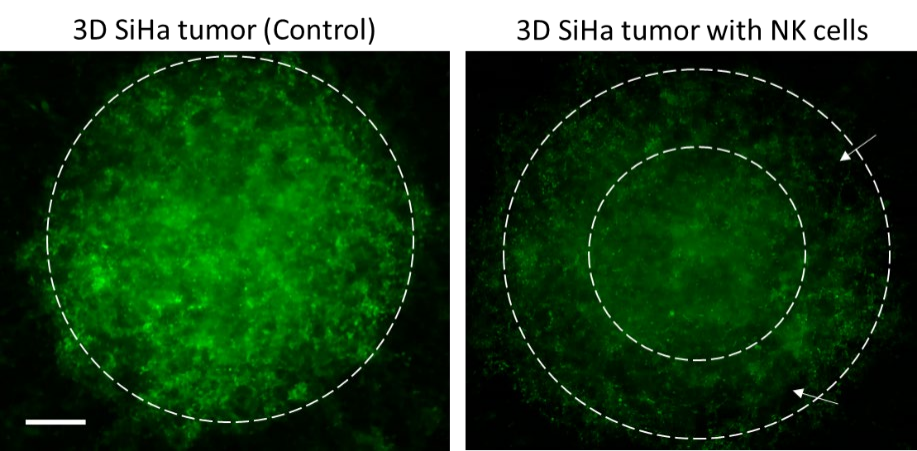
图4. 肿瘤细胞杀伤模式。 在没有NK 细胞的情况下,SiHa 肿瘤表达明亮的 GFP 荧光。 然而,当与NK 细胞共培养时,整体 GFP 荧光强度降低,这在打印肿瘤的外同心环(白色箭头指示的白色虚线)(右图)中是显着的。比例尺 = 500 µm。
结论和今后的方向
Ø 液滴三维生物打印技术可以作为一种自动化的过程,以人宫颈癌细胞SiHa和CaSki为代表的多功能体内模型,以促进免疫肿瘤学研究。
Ø 在与人NK细胞共培养的过程中,3D生物打印的肿瘤细胞在胶原基质中保持受限和存活。
Ø 在细胞毒性试验中,人外周血来源的NK细胞显示出细胞浓度(E:T比值)依赖性的癌细胞杀伤增加。
Ø NK细胞细胞毒性试验与高含量成像工作流程兼容,也可适用于其他肿瘤模型,包括PDX有机化合物,以加速药物筛选过程,并推动个性化药物的临床翻译。
Ø 此外,BIO X上的多壁生物打印格式可用于扩大对生物制剂(如免疫检查点抑制剂)和工程NK细胞(CAR-NK)的高通量筛选的支持。
Ø 进一步的研究可能包括定量肿瘤中NK细胞的浸润和肿瘤或T细胞释放的细胞因子。
参考文献
1. Burke S, Lakshmikanth T, Colucci F, Carbone E. New views on natural killer cell-based immunotherapy for melanoma treatment. Trends in Immunology. 2010; 31(9): 339–345. DOI:10.1016/j.it.2010.06.003.
2. Garrido F, Aptsiauri N, Doorduijn EM, et al. The urgent need to recover MHC class I in cancers for effective immuno-therapy. Current Opinion in Immunology. 2016; 39: 44–51. DOI:10.1016/j.coi.2015.12.007.
3. Giannattasio A, Weil S, Kloess S, et al. Cytotoxicity and infiltration of human NK cells in in vivo-like tumor spheroids. BMC Cancer. 2015; 15(1): 351. DOI:10.1186/s12885-015-1321-y.
4. Kercher EM, Nath S, Rizvi I, Spring BQ. Cancer cell-targeted and activatable photoimmunotherapy spares T cells in a 3D coculture model. Photochemistry and Photobiology. 2020; 96(2): 295–300. DOI:10.1111/php.13153.
5. Long EO, Kim HS, Liu D, et al. Controlling natural killer cell responses: integration of signals for activation and inhibition. Annual Review of Immunology. 2013; 31: 227–258. DOI:10.1146/annurev-immunol-020711-075005.
6. He W, Kuang Y, Xing X, et al. Proteomic comparison of 3D and 2D glioma models reveals increased HLA-E expression in 3D models is associated with resistance to NK cell-mediated cytotoxicity. Journal of Proteome Research. 2014; 13(5): 2272–2281. DOI:10.1021/pr500064m.
 【开讲啦】Amira-Avizo 三维可视化与分析软件专家分享会
【开讲啦】Amira-Avizo 三维可视化与分析软件专家分享会

 评论
评论