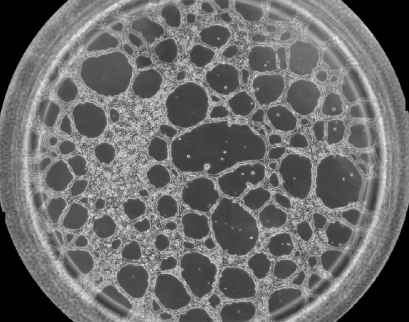
1、哪种细胞密度最适合我的实验?
通常,我们建议每孔使用5,000-10,000个HUVEC。 但是,确定最佳细胞数对于使用µ-Slide血管生成从管形成测定中获得最佳结果是至关重要。 细胞密度取决于细胞类型和细胞大小。 因此,在开始实际实验之前,我们建议在非抑制条件下播种几个细胞数并对管形成进行成像。 然后,对于最佳测定条件,使用在您的实验中产生最多管数的细胞密度。请记住,细胞通常不会在凝胶基质上增殖。请参阅:血管生成实验实验装置优化和数据分析 |ibidi µ-Slide
2、应该在哪个时间段内观察细胞?
管形成的持续时间取决于细胞类型和所使用的细胞外基质,应单独确定。 通常,HUVEC在 2-4小时后已经形成管。24小时后细胞开始发生凋亡,这导致从基质中脱离和管破裂。请参阅:血管生成实验实验装置优化和数据分析 |ibidi µ-Slide
3、是否需要活细胞成像装置来每小时拍摄管形成测定的照片?
非必须,通过显微镜对 µ-Slide 血管生成上的同一位置进行一致和精确的成像。 可以使用显示 x/y 坐标的显微镜载物台或自动载物台来完成成像。 使用自动化平台,可以将孔的所有位置(特别是每个孔的中心)保存到位置列表中,您可以在每个时间点访问相应的位置。
但是,使用完整的活细胞成像设置在显微镜上建立生理条件要方便得多。使用ibidi Stage Top 孵育系统等活细胞孵育装置有助于在成像过程中提供稳定温度和湿度条件,从而在体外可以直接进行视频拍摄。
4、是否可以使用 µ-Slide 血管生成在凝胶基质内培养细胞?
可以,µ-Slide 血管生成非常适合在精确定义的3D基质中培养细胞。由于大界面的凝胶和顶部细胞培养基,凝胶中的条件可以通过更换上部储液器中的介质来调整。
5、应该在管形成实验中使用含酚红的凝胶还是不含酚红的凝胶?
对于使用µ-Slide血管生成的管形成测定中的相差显微镜,酚红不会干扰图片,并且由于其颜色,处理更容易。然而,当使用荧光显微镜时,酚红可能会干扰探头的波长。在这种情况下,应该使用无酚红凝胶。
6、是否需要将µ-Slide Angiogenesis血管生成载玻片放入培养箱的湿室中进行凝胶聚合?

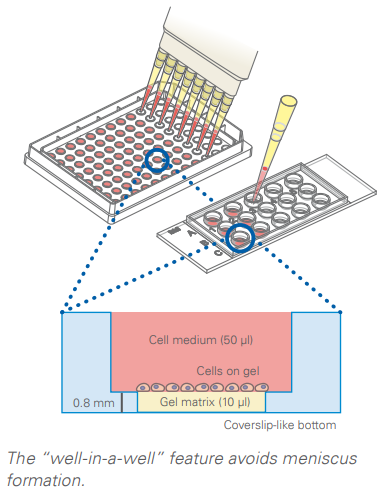
我们建议将µ-Slide血管生成载玻片放入加湿腔中进行凝胶聚合。 虽然反应室对于聚合本身不是必需的,但它可以最大限度地减少蒸发的影响。 在高流量孵化器中,防止蒸发的足够百分比的湿度可能不会始终保持一致。 µ-Slide血管生成中的少量凝胶会很快变干,这会导致弯液面的形成。
7、胎牛血清 (FBS) / 胎牛血清 (FCS) 浓度是否会影响管形成实验中的管形成和降解速率?
一般是的。 这取决于所使用的细胞类型或细胞系。 当提供浓度高达 10% FCS 的细胞培养基时,我们在 µ-Slide 血管生成中观察到典型的原代细胞 (HUVEC) 管形成和 Matrigel® 上的几种内皮细胞系。 但是,我们建议分别优化每个细胞系的 FBS/FCS 浓度。
8、您是否推荐使用减少生长因子的 Matrigel® 进行管形成分析?

对于使用µ-Slide血管生成的管形成测定,我们使用了减少生长因子的 Matrigel® 和未减少的 Matrigel®。请参阅:肿瘤学必备 | 血管生成实验介绍
9、我们希望使用减少了生长因子的 Matrigel® 和无血清培养基以及 50 ng/ml VEGF。 这足以刺激管的形成吗?
可以,这种组合足以刺激ibidi血管生成实验室器皿中的管形成,而培养基中没有任何额外的生长因子。
10、除了 Matrigel® 之外,您在试管形成实验中是否有使用其他凝胶的经验?
原则上,任何凝胶都可用于µ-Slide血管生成管形成实验。 细胞可以附着在表面上是很重要的。 胶原蛋白、纤连蛋白和层粘连蛋白为细胞粘附提供了重要的结合基序。
11、什么是管形成实验合适的阳性和阴性对照?
建议使用阳性和阴性对照来减少管形成实验中的变量。阳性对照是预期细胞在其中形成血管的样本(取决于实验设置),从而向研究人员表明该实验已正确进行。阴性对照是与所有其他样品以相同方式处理的样品,但预计不会显示任何实验结果(例如,很少或没有管形成)。
ibidi血管生成实验室器皿中管形成实验的最佳阳性和阴性对照很大程度上取决于所使用的细胞、凝胶基质和一般实验设置。因此,我们建议您查阅文献,了解您感兴趣的主题中成功使用的对照(阳性和阴性对照)。
在下文中,您可以找到管形成测定中阳性和阴性对照的可能方法:
如果需要分析特定化合物诱导血管生成的效力,则可以使用用已知血管生成诱导剂(例如 VEGF 或 FGF2)处理的样品作为阳性对照。浓度很大程度上取决于细胞类型和实验设置。
如果使用原代细胞,预筛选的内皮细胞系(例如,HUVEC)在用特定生长因子处理后表现出明确的反应,可以作为阳性对照。
对于某些细胞类型,形成管的能力还取决于所使用的凝胶基质。作为阳性对照,内皮细胞应在含有饥饿培养基(不含生长因子或血清的培养基)的生长因子减少的 Matrigel®上显示管形成。如果需要测试促血管生成物质,则使用饥饿培养基尤其重要,因为大多数细胞培养基都添加了生长因子。为了分析物质的真实效果,基质和培养基都必须不含任何生长因子。作为阴性对照,细胞可以播种在不同的基质(例如胶原蛋白 I)上,预计不会形成管状。
不影响细胞活力的管形成抑制剂(例如,苏拉明或萝卜硫素)可用作阴性对照。如果实验的目的是测试抗血管生成物质,则使用这种类型的抑制剂尤其重要。
如果用任何溶解的物质(例如,在 DMSO 或乙醇中)处理细胞,则仅使用溶剂作为阴性对照。
12、是否有用于分析管形成实验的推荐染色方案?
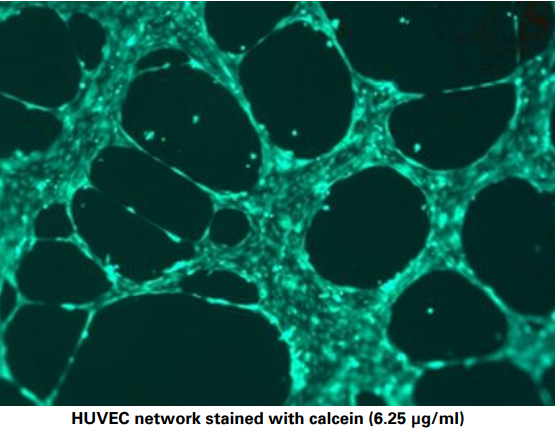
一般来说,相差显微镜足以自动分析 µ-Slide血管生成中的标准管形成实验。 但是,如果您想研究某种标记,您可以应用您的标准方案(例如,用于免疫荧光染色),但要小心,以免损坏凝胶基质或细胞网络。
使用calcein的染色方案示例可参阅:肿瘤学必备 | 血管生成实验介绍
13、在开始实验之前,我是否必须将 ibidi 血管生成实验室器皿平衡到 37°C?
不,不需要平衡 µ-Slide 血管生成。 在室温下储存,可以立即用凝胶基质填充。 由于µ-Slide 的开孔形式,加热时从凝胶中逸出的气体可以与大气自由交换。
14、完成实验后,µ-Slide Angiogenesis和µ-Plate Angiogenesis 96 Well可以重复使用吗?
不可以,µ-Slide血管生成载玻片和µ-Plate血管生成96孔板是一次性耗材,仅供一次性使用。
15、µ-Slide 血管生成是否有96孔版的?
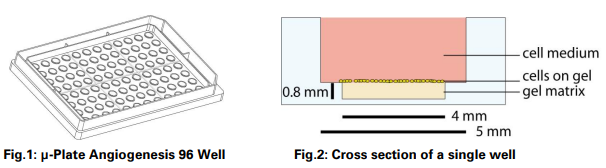
有。 µ-Plate血管生成96孔板具有与µ-Slide血管生成相同的“孔中孔”设计和凝胶体积 (10 µl)。 µ-Plate血管生成96孔可用作高通量管形成实验的筛选板,具有完全的ANSI/SLAS (SBS) 和robotics兼容性。
 ibidi细胞培养科普知识系列,带您了解实验小常识~
ibidi细胞培养科普知识系列,带您了解实验小常识~

 评论
评论