生物药品活性成分常用检测方法及局限性
随着生物药品的迅速发展,研究人员将面临的一项挑战任务是开发一种可靠、耐用和GX的检测方法,以在体外和体内检测和量化有效的生物药品成分。
Z常用的方法包括经典配体结合测定(LBAS)、LC-MS的测定,以及新出现的LBA-LC-MS混合技术。 LC-MS和LBA-LC-MS是一个技术先进的方法,但是操作复杂,周期长,通量低,成本高,不适合于快速筛选和早期开发研究大样本量的实际需求。
对于LBAS而言,ELISA是Z常用的用于定量目的的方法。虽然在技术上要求较低并且成本低,但它高度特异性的抗体对,但是新的重组肽或蛋白质通常是不容易拿到高质量的抗体对。筛选可用的抗体对是耗时和费力的,涉及昂贵的纯化步骤,并且依赖于使用的动物。另外,抗体可能无法检测所有重组蛋白质构建体变体。
另一种常见的LBA是传统的Western印迹法,但是无法准确定量,操作繁琐,不稳定,不符合生物药品准确性,耐用性和稳定性的要求。
基于Wes建立生物药品活性成分检测方法
(体外稳定性实验和体内药物代谢动力学)
俄亥俄州立大学药学院的科学家,基于ProteinSimple的Wes定量Western blot技术开发了一种新的,GX,高灵敏度的定量工具,以支持ZL性重组蛋白的早期开发,避免上述限制。
An efficient and quantitative assay for epitope-tagged therapeutic protein development with a capillary western system,Bioanalysis,Published online:20 March 2019。
简述:本研究使用的重组蛋白,分子量约为55kDa,N端6X-His-标记,C末端DYKDDDDK(FLAG)。抗体:生物素化的抗Flag抗体,链霉亲和素-HRP。Wes单次可以检测25个样品,在从样品处理开始到数据采集的6小时内(Wes操作及检测时间约为3.5小时).
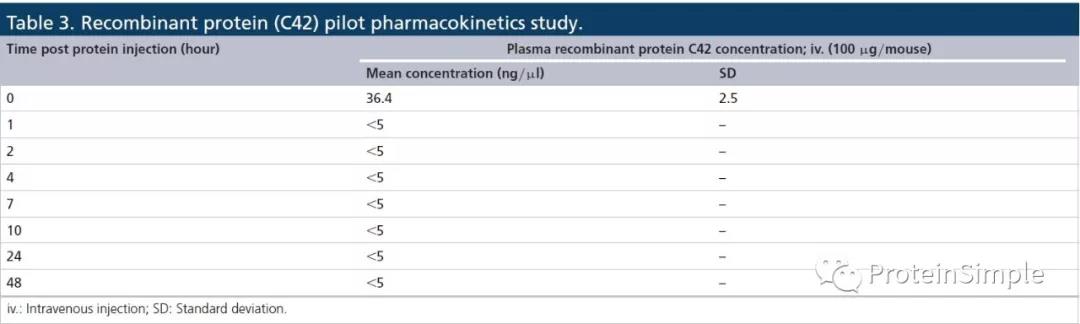
LLOQ为0.4nM(20ng/mL)。作者基于该平台完成了一个方法开发快,GX的,检测速度快的重组蛋白类药物的体外稳定性研究和药代动力学(PK)研究的技术平台,且无需产生特异性单克隆抗体。该方法也消除了目标蛋白富集步骤,富集可能引入显著的样本间变异性。

Wes自动化的免疫测定平台,基于毛细管电泳技术,整合了免疫学检测方法。
在生物制药领域具有一系列独特优势
1. 全程自动化
2. 精密度高
3. 耐用性好
4. 灵敏度高
5. 准确定量
部分结果
精密度

体外稳定性实验

体内药物代谢动力学(PK)实验
作者文章总结
• Development and validation of a reliable, robust and efficient assay to detect and quantify macromolecules in vitro and in vivo during the early stage of a biotherapeutic agent discovery remain a major challenge for researchers, especially in the academia setting where resources can be limited.
• A simple (enrichment-free), highly sensitive and efficient immunoassay using a capillary-based western system to assess the in vitro stability and pharmacokinetic properties of propitious epitope-tagged recombinant proteins in vivo in mouse to support an early stage development of a lead therapeutic recombinant protein.
• The method validation results demonstrated satisfactory characteristics in specificity, linearity, accuracy and precision.
• This protocol avoids the need of laborious and costly customized monoclonal antibody as is typically essential for an ELISA or multistep enrichment process which are often indispensable when employing a liquid chromatography–mass spectrometry-based method.
• The protocol is capable of quantifying up to 25 samples at the dynamic concentration range from 5 to 200 ng/ml with an LLOQ of the target protein at 0.4 nM (20 ng/ml).
(来源:ProteinSimple)

 评论
评论