
2019年11月26日,刊登在Nature communication上的研究报告指出,一种与T淋巴细胞结合的抗体衍生物,重新定向T淋巴细胞以溶解肿瘤细胞。
T细胞的免疫疗法正在改变当前癌症ZL的前景。但是,缺乏合适的靶抗原,将这些策略限制在极少的肿瘤类型上。在这里,本文报道了一种T细胞结合抗体衍生物,该衍生物分为两个互补的半部分,并针对抗原组合而不是单个分子。现在,每半个部分都是半抗体,包含与抗CD3抗体的可变轻链(VL)或可变重链(VH)融合的抗原特异性单链可变片段(scFv)。当两个半抗体同时在单个细胞上结合各自的抗原时,它们会对齐并重组原始CD3结合位点以与T 细胞结合。本文表明,通过这种方法,T淋巴细胞可专门消除双重抗原阳性细胞,同时保留单个阳性癌旁细胞。这使不适合当前免疫疗法的精确靶向ZL成为可能。
单克隆抗体代表了现代药物ZL中增长Z快的领域之一。在临床前和临床研究中目前列出的数百种ZL性抗体和抗体衍生物中,有一些脱颖而出,其ZD是将细胞毒性T淋巴细胞重新靶向恶性细胞。其中,Z先进的是将嵌合抗原受体(CARs)转染到T细胞和双特异性T细胞结合抗体(BiTE),两者均使用单特异性单链可变片段(scFv)作为靶向装置。总的来说,这些抗体衍生物所针对的靶分子是存在于恶性细胞及其未转化的对应物上的分化抗原,它们的结合常常引起严重的,甚至致命的不良事件。由于适用于基于抗体疗法的真正的肿瘤特异性抗原很少见,因此本文在这里研究一种组合方法,该方法可以解决由某些类型的白血病或淋巴瘤,实体癌和其他来源的癌干细胞异常表达的抗原组合。此外,鉴于结合T细胞疗法的临床有效性,本文以双重抗原限制的方式重定向T淋巴细胞以裂解肿瘤细胞。
半抗体消除体内已建立的肿瘤
为了测试半抗体的潜在ZL适用性,对免疫缺陷的NOD/SCIDγ(NSG)小鼠进行了体内免疫接种。在第1天接种萤光素酶基因标记的THP-1肿瘤细胞。在第1、22和28天,尾静脉接种HLA-A2阴性的CD4和CD8供体T淋巴细胞。在第7天植入肿瘤细胞后,每天皮下分别注射:盐水、单个半抗体、两个半抗体的组合及这是双特异性T细胞结合抗体(BiTE)对照。直到第39天。为了研究半抗体是否可以相互发现以实现靶标功能互补,将构建体彼此分开注射在较远的位置,一个在颈部,另一个在后肢上。尽管所有接受盐水或单个半抗体的小鼠疾病发展迅速,并在53天内达到了安乐死的标准,但用两个半抗体对或BiTE对照ZL的小鼠却排斥了已建立的肿瘤(下图a)。接受半抗体对或BiTE对照的小鼠的总生存期显著延长。
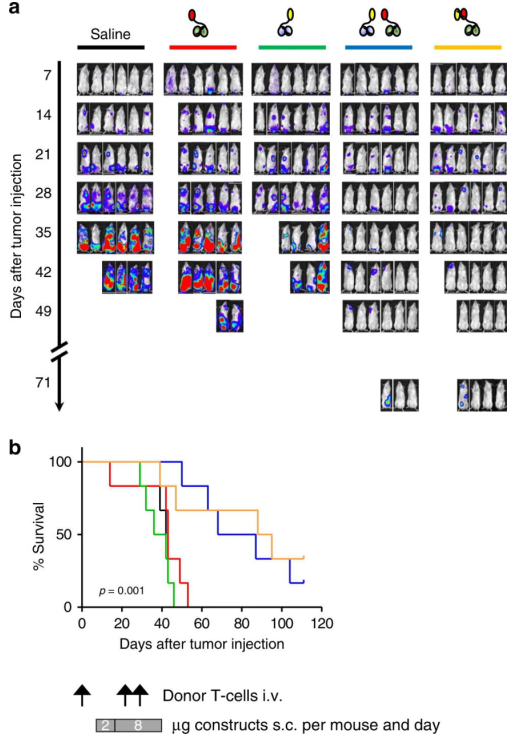
上图:体内高精度靶向癌细胞
a.通过IVIS Lumina XR实时生物发光成像,每周评估一次荧光素酶基因标记的THP-1肿瘤细胞的生长
b.每天监测生存期,直到第110天
半体技术的组合性质为特异性ZL开辟了新的领域。它可能选择性消除不适合当前免疫疗法的人类癌症,并且与旨在增强对靶标亲和力的其他双重或三重抗原特异性策略大不相同。
尚不清楚半抗体是否会诱导细胞因子释放综合征,这是双特异性T细胞结合抗体(BiTEs)或针对抗原(例如CD19)的CAR-T细胞的主要缺陷。在这种情况下,甚至用半抗体处理单个靶分子也是合理的,以便将T细胞活化专门限制在肿瘤部位,同时减少血管内T细胞活化和全身细胞因子分泌。 综上所述,本文研究的半体技术将成为用于组合高精度免疫靶向以消除恶性细胞及其他恶性肿瘤的通用平台。

 评论
评论