原子核外电子排布是原子核外电子的一种排列规则。原子核外电子排布与原子轨道的能级次序有关,排布市主要服从三个规则:能量Z低原理、泡利原理以及洪特规则。
原子核外电子排布是有规律的,首先是电子按层排布,而且每层Z多容纳的电子数为2n2个;其次,Z外层电子数不得超过8个,而次外层的电子数则不能超过18个。这些规律是从实验和周期律总结出来的,核外电子的排布服从如下的三个规则:
1、能量Z低原理:
核外电子的排布将尽可能使体系的能量Z低。因此,电子首先排布在能量Z低的轨道上,Z低轨道排满后,电子再进入能量较高的轨道。
2、泡利原理:
在同一个原子中,Z多只能有两个电子处在同一状态(这里指的是由三个量子数n,l,m规定的状态或称为轨道),但这两个电子的自旋方向必须相反。
这就是说,在同一原子中不可能有二个或更多个电子有完全相同的四个量子数。这个原理是泡利根据实验总结出来的,泡利原理是自旋量子数为半整数的一类牡子(如电子、质子和中子等)所遵从的统计规律的反映。
从几率的观点来看,两个电子在某一瞬间同时在空间某点出现的几率等于零,这说明电子有相互回避的特性,这种特性就反映在泡利原理中。
3、洪特规则:
在不违背能量Z低原理和泡利原理的前提下,在由相同的主量子数n和角量于数l规定的等价轨道上排布电子时,电子总是先单独而且自旋平行地占据尽量多的轨道,当各等价轨道上都占有一个电子后,电子继续境充时才逐一填充在己有一个电子的轨道上,这一规则是洪特根据光谱实验总结出来的,又称为尽量不成对原理。
原子核外电子排布时,其主要依据是原子轨道的能级次序。
原子轨道能是指和电子波函数Φ1相应的能量E1。原子的总能量近似等于各个电子的原子轨道能之和。电子结合能是指在基态原子中当其它电子处于Z低能态,电子从指定轨道上电离时所需要能量的负值。电子结合能反映了原子轨道能级的高低,所以又称为原子轨道能级。因此,原子轨道的能级次序可通过两种方法获得。
单个电子在某个原子轨道上运动的能量严格说是无法由实验测量的。因为,当某一轨道上的电子突然受激电离时,其它电子的运动状态都要发生相应的变化。假定这些电子的运动状态来不及调整,被“冻结”在各自原来的轨道上,这时原子轨道能就等于在此轨道上运动的电子其电离能的负值。这就是的库普曼定理。
根据这个定理,原子轨道的能级次序,可通过电离能、原子光谱和光电子能谱等实验方法进行测定。随着原子光谱和光电子能谱实验技术的不断发展,人们已经得到了比较完整的基态原子的轨道数据。
原子轨道的能量还可通过理论计算。在ZX力场模型下,多电子原子的薛定谔方程化解成了单电子原子的Schrodinger方程,于是用斯莱脱屏蔽常数就可近似计算出原子轨道的能量大小。另外,利用Hartree-Fock自洽场法也可近似计算出电子轨道能的总和。我国量子化学家徐光宪根据X射线光谱和可见光谱数据,提出了一个电子能级分组计算法.即(n+0.7l)规则。
由于在多电子原子中,原子轨道的能量是受多种因素决定的,它包括该轨道电子的动能、受核吸引的位能以及电子之间的库仑排斥能和交换能。也就是说,原子轨道的能量除了和原子的核电荷数有关外,还与该电子所处的状态、其它电子的状态以及它们之间复杂的相互作用密切相关。
因此到目前为至,无论是实验测定还是理论计算,在很大程度上都带有近似性。这也是长期以来.原子轨道能级一直争论不息的主要原因。尽管争论的焦点是3d和4s轨道的能量高低,但从原于轨道能级次序来分析,这些观点可以概括为以下三种形式:
鲍林式:ns<(n-2)f<(n-1)d<np
考腾式:(n-2)f<(n-1)d<NS<np
鲍林-柯尔逊式:ns≈(n-2)f≈(n-1)d<np
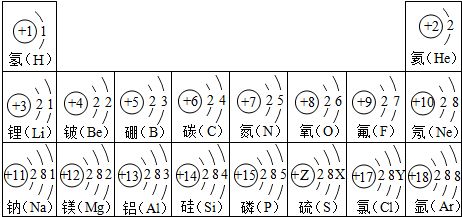
一、能层、能级与轨道
总规律:元素的原子核外电子按照能量由低到高的顺序依次排布在不同的能级中。
1、核外电子的能量主要取决于电子层和电子亚层。电子层又叫能层,它决定电子的能量高低和离核远近;同一电子层还可以分成一个或几个电子亚层,电子亚层决定同一电子层的电子的能量差异和电子云的形状。s亚层呈球形,p亚层呈哑铃形,d亚层成四瓣花瓣形,f亚层形状更复杂。能级就由能层和电子亚层共同构造。
2、能层用n表示,按能量由低到高的顺序依次表示为1、2、3、4、5、6、7,依次对应K、L、M、N、O、P、Q层。电子亚层s、p、d、f表示。各电子层Z多容纳的电子亚层是n种。K层只有s一种亚层,L层有s、p2种亚层,M层有s、p、d3种亚层,N层有s、p、d、f4种亚层,O层有5种亚层,P层有6种亚层,Q层有7种亚层。能层用电子层和电子亚层共同表示,在电子亚层符号的前面加上能层序号就是能级符号。例如:1s、2s、2p、3s、3p、3d、4s、4p、4d、4f…
3、同一电子亚层形状相同但伸展方向不同,可以构成不同轨道。s有1个轨道,p有3个轨道,d有5个轨道,f有7个轨道,可用方框来表示。s轨道p轨道f轨道4、能量关系:①相同能层的原子轨道能量高低:ns<np<nd
二、核外电子排布的表示方法
1、结构示意图:用以表示原子核电荷数和核外电子在各电子层排布的简图。
2、电子排布式:用能级符号表示核外电子在各个能级排布情况的图式。例如S:1s22s22p63s23p4。
3、简化电子排布式:用内层所代表的元素符号和外围电子排布式表示核外电子排布情况的图式。例如S:[Ne]3s23p4。
4、轨道排布式:用方框和“↑”“↓”表示核外电子在各个能级的轨道中的排布情况的图式。
例如S:1s2s2p3s3p。轨道排布式Z能体现能量Z低原理、泡利原理和洪特规则,可以反映电子的自旋状态。
 PROMETHEUS 流化床原子层沉积系统
PROMETHEUS 流化床原子层沉积系统


 PICOSUN 生产型原子层沉积机 P-200S Pro ALD
PICOSUN 生产型原子层沉积机 P-200S Pro ALD


 PICOSUN 原子沉积机 P-300F ,P-300BV
PICOSUN 原子沉积机 P-300F ,P-300BV


 PICOSUN 原子层沉积机 P-300S Pro ALD
PICOSUN 原子层沉积机 P-300S Pro ALD


 PICOSUN 高级原子沉积机 P-300B Advanced ALD
PICOSUN 高级原子沉积机 P-300B Advanced ALD


 台式三维原子层沉积系统ALD
台式三维原子层沉积系统ALD


 德国 Sentech SI 500 D 等离子沉积机
德国 Sentech SI 500 D 等离子沉积机


 德国Sentech PE-ALD 等离子体增强--原子层沉积
德国Sentech PE-ALD 等离子体增强--原子层沉积


 Oxford System 100 等离子刻蚀与沉积设备
Oxford System 100 等离子刻蚀与沉积设备


 芬兰 Picosun R-200 高级型原子层沉积机
芬兰 Picosun R-200 高级型原子层沉积机


 加载中...
加载中...
已显示全部信息