用于组织工程支架血管化的微管嵌入水凝胶生物打印
2024-05-15328摘要
血管组织工程被认为是有前途的可行的人造组织和器官的替代方案之一。采 用各种技术制造的宏观和微观空心管已被广泛研究以模拟血管。迄今为止,尺寸从 1 微米到 10 微米的仿生毛细血管的制造仍然具有挑战性。在本文中 , 通过静电纺丝来模拟毛细血管,并将芯鞘微管嵌入羧甲基纤维素/海藻酸钠水凝胶中进行生物打印。结果显示打印保真度得到改善并促进细胞附着。 管浓度和管长度对细丝尺寸和合并面积都有显着影响。具有较高微管浓度的 打印组表现出较高的微管密度,灯丝/喷嘴尺寸比以及打印/设计的网格面积 比接近100%。在体外实验中,微管不仅与人脐静脉内皮细胞相容,而且还提 供了微地形线索, 以促进三维空间中的细胞增殖和形态发生。总之,我们小 组制造的微管具有用于血管化软组织支架生物打印的潜力。
关键词
生物打印,芯鞘静电纺丝,水凝胶,微管,血管组织工程
1 | 引言
心血管疾病(CVD)是全Q死亡的主要原因(世界卫生组织,2022 ) 。尽管自体血管移植被认为是临床治疗的金标准,但传统的移植方 法受到供体数量的限制,可能会导致继发性血管阻塞(Kucukgul et al. , 2015; Pashneh-Tala et al., 2016)。血管组织工程的发展为心血管 疾病带来了新的治疗方向。通过用合成移植物替换残疾血管,可以重 建血管系统,并可以绕过闭塞和动脉瘤(Song et al., 2018)。大直 径(>8mm)和中直径(6-8mm)的合成移植物主要通过成型和生物 打印来模拟血管网络来制造(Fazal et al., 2021)。然而,传统的制 造方法通常无法制造尺寸为亚10微米级别的毛细管拟态和生物相容性 微血管系统。
近年来引入静电纺丝来制造毛细血管(Zhou et al., 2018)。通过 向液滴施加高电压,静电斥力抵消表面张力并拉伸液滴。一旦排斥 力克服了表面张力,泰勒锥就会形成并导致喷发(Kong et al.,2010)。借助静电纺丝技术,可以制造微米到纳米级的纤维。在 我们之前的研究中,开发了芯鞘静电纺丝以获得模拟毛细血管的管 状结构(Zhou & Tan ,2020a)。将两种静电纺丝溶液同时泵入 芯鞘喷丝头,随后芯溶液溶解(Zhou et al., 2021)。在另一个例 子中,吴等人。 (2020) 使用芯鞘静电纺丝来制造聚乳酸-乙醇酸 共聚物和聚乳酸的混合纤维, 以促进机械完整性、细胞附着和增殖 。尽管越来越多的研究致力于推进静电纺丝在血管组织工程中的应 用,但由于静电纺丝的固有性质,许多工作都集中在没有宏观形态 控制的二维(2D)支架的制造上。为了解决这个问题,Z新的研究 一直集中在增材制造技术上,例如用于制造人造血管的生物打印。
生物打印通常用于打印合成软组织并为细胞生长提供细胞外基质环境 (Huang et al., 2021)。人们已经做出了许多努力来使用生物打印 技术来制造血管模拟物,该技术可以提供均匀的细胞负载生物墨水。 例如,徐等人。(2018)利用双层圆形支撑支架和生物打印的小直 径血管替代品。弗里曼等人。(2019) 将纤维蛋白原与明胶混合,在 旋转收集器上打印血管结构。关于生物打印材料,海藻酸钠(SA) 由 于其生物相容性、生物可降解性以及对二价抗衡离子的快速交联反应 , 是细胞培养中使用Z广泛的生物打印材料之一(Asadi et al.,2020)。另一方面, 由于其流体特性,纯 SA 溶液的打印通常会导 致打印保真度和结构完整性较差。此外,细胞亲和力的缺乏导致细胞 附着和增殖低。为了解决这些问题,研究人员将SA与其他生物材料混 合,例如凝胶(Mondal等,2019)、胶原蛋白(Yang等,2018)和羧甲基纤维素(CMC)(Zhang等,2021), 以改善机械性能特 性并Z大限度地减少生物惰性(Sun & Tan ,2013)。此外,静电纺 丝与生物打印的结合在血管组织工程中显示出日益增长的趋势。例如 , 金等人。 (2022) 在电纺微纤维上生物打印复合生物墨水, 以实现 更好的细胞粘附。在生物墨水中添加电纺纤维是为印刷组织提供内部 支撑的另一种方法。赵等人。 (2020) 将分散纤维与 CaP 粉末混合 用于3D 打印,Chen 等人。 (2020)将纤维与软骨脱细胞基质混合 来制造软骨组织支架。所有研究均表现出高印刷适性和良好的生物相 容性。然而,纤维在收集器表面随机静电纺丝,导致微纤维分布不均 匀。此外,水凝胶中的纤维混合物显示生物墨水中缺乏微管结构。
在这项研究中,静电纺丝和生物打印技术相结合来制造用于生物打印的管装水凝胶。本研究的目的是研究静电纺丝微管对复合支架打印 保真度和生物相容性的影响。假设是 (1) 在生物打印水凝胶中包含微 管将改善或至少保持可打印性和打印保真度, (2) 嵌入的微管将促进 3D 结构中的细胞粘附和活力。为了检验假设,选择了水凝胶内微管浓 度的三个水平和平均微管长度的三个水平。结果表明,添加缩短的微 管显着提高了打印保真度和细胞附着。这项研究有可能为组织工程应 用中亚 10 微米尺度的人工毛细血管化支架制造的进步贡献知识。
2 | 材料和方法
2.1 | 静电纺丝溶液配制
聚乙二醇(PEO,分子量=100,000)粉末和SA粉末购自Sigma- Aldrich。聚苯乙烯(PS,分子量 = 260,000)颗粒来自 AcrosOrganics 。 CMC 粉末获自MP Biomedicals。二氯甲烷 (DCM) 购 自 Marron Fine Chemicals。去离子水(DI 水)取自 Millipore Milli -Q 系统。食品级染料购自 Chefmaster。
通过将17%wt/vol PS(鞘液)和12%wt/vol PEO(芯液)分别 溶解在DCM中,在室温下磁力搅拌4小时来制备静电纺丝溶液。首先 将带有电纺微管的垫子浸入去离子水中 12 小时以溶解 PEO 核。然 后将干燥的垫切成 5mm×5mm 的块,并通过超声波振动(Fisherband Model 50 声波粉碎机)在 20 kHz 和 100% 声波强度下破碎 1 和 2 分钟。通过在扫描电子显微镜(SEM) 图像中随机选择20个 微管并手动测量微管壁与端部之间的距离来测量微管直径和长度。基 于管浓度(wt/vol%)和微管长度(μm)的五组被设置为对照(无微 管)、0.05%长(长长度为0.05% PS微管)、0.05%短(短为0.05 % PS微管)长度),长 0.1%,短0.1%。在每次超声振动中,称重 12.5mg 微管并分散在 10ml 70% wt/vol 乙醇中。室温风干后,将 3% wt/vol CMC 和 1% wt/vol SA 与破碎的微管溶解在去离子水中 , 通过磁力搅拌 72 小时制成生物打印溶液。
2.3 | 生物打印
生物打印过程在BIO X生物打印机(Cellink)上进行,实验流程如图1 所示。
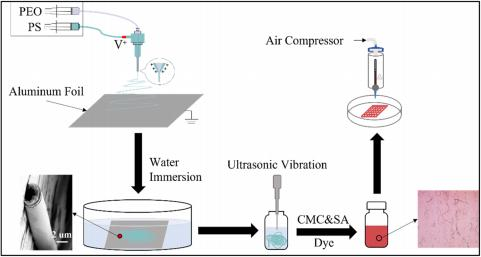
FIGURE 1 实验过程示意图。 CMC,羧甲基纤维素; PEO、聚乙二醇; PS、聚苯乙烯; SA ,海藻酸钠。
生物墨水用食品级染料染成不同颜色。复合生物墨水是从连接到喷 嘴直径为 0.41 毫米的空气压缩机的 3 毫升注射器中挤出的。对于 所有五组,挤压压力均为 20 kPa,扫描速度设置为 10 mm/s。每 组选择三个重复。为了测量不同组的细丝尺寸和合并面积, 以 10% 填充密度和 0.41 mm 层高打印 20 × 20 × 1mm 网格(图 2a 、b ) 。随机选择20根细丝进行尺寸测量,并取10个样品进行合并面积 测量。

FIGURE 2 (a) 长丝尺寸测量。 (b) 合并面积测量。 (c) 微管对准分析。 (d1-d3)微管密度分析:(d1)原始图像(d2)灰度图像(d3)阈值二值图像(比例尺= 1毫米)
为了测量打印结构内的微管密度,在培养皿上为每组打印另一个 20 × 20 × 0.5 mm 的单层,填充密度为 10%,层高为 0.12 mm。每组 采集十个样品进行密度分析。所有样品均使用 EVOS XL Core 光学显 微镜 (Thermo Fisher Scientific Inc.) 进行观察,并通过 ImageJ (LOCI) 进行分析。进行方差分析(ANOVA)进行统计分析。分别以微 管浓度和超声处理时间为变量, 以微管密度为响应变量。通过统计分 析软件(北卡罗来纳州立大学)计算p值来证明假设。将图像转换为 16 位以进行像素分析(图 2d)都需要微管密度和对齐分析。一些微 管包括珠子形成。密度分析通过调整图像的灰度阈值来识别微管,并 计算暗区的比例以获得微管密度。
比对分析是通过OrientaionJ软件包进行的,该软件包是ImageJ中的 插件之一。通过评估局部邻域内的梯度结构张量,可以表达图像的方 向和各向同性性质。在本研究中,我们将局部邻域的标准差设置为2 个像素,并通过三次样条方法计算梯度。结果绘制了从-90°到90°不 同程度的微管取向分布。如图2c所示,0度代表水平微管,90度代表 垂直微管。 0 度的高取向分布意味着大多数微管是水平的并且具有与 生物打印方向相同的方向。 Y 轴表示图像处理中对齐分析检测到的像 素数。
2.4 | SEM
将五组水凝胶在搅拌热板(Thermo Fisher Scientific)上于 65°C 加热一小时。水凝胶充分干燥后,用溅射镀膜机对样品进行镀膜1分钟。使用场发射SEM(Zeiss的Supra 55 VP) 以15 kV电子高压在 ×245放大倍数下拍摄SEM图像。
2.5 | 流变测试
流变学和粘度测量由 TA Instruments Discovery HR 30 流变仪(Waters) 进行。通过在固定 1.0% 应变下将角频率从 0.1 改变到100.0 rad/s 来测量水凝胶的储能模量和损耗模量。通过改变 1 至 100 1/s 的流量扫描来研究剪切应力和粘度。两个程序的温度均保持 在 25°C,浸泡时间为 180.0 秒。
2.6 | 膨胀测试
将五组(10 mm×10 mm×10 mm )的微管嵌入水凝胶立方体交联并 浸入3 mL 20% CaCl2 溶液中。交联 24 小时后,将立方体从 3D 打印模具中取出, 以确保立方体完全交联。然后将立方体浸入去离子 水中,每 12 小时称重一次,通过公式(1)计算其膨胀率。初始重 量(W0)为24小时时的重量,36小时、48小时、 96小时时 的重量为湿重(Wt)
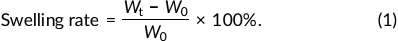
2.7 | 渗透性测试
将五个圆盘(30 mm×30mm×3mm)成型并在20%CaCl2溶液中 交联24小时,共五组。然后将圆盘浸入食品级染料中,液位与圆盘高度相匹配。渗透率可以从染色区域观察,渗透率可以通过以下公式计 算:

2.8 | 细胞毒性评价
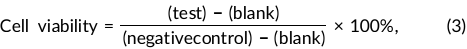
通过细胞计数试剂盒 8 测定 (CCK-8) 评估 PS 微管对人脐静脉内皮 细胞系(HUVEC,源自 Angio-Protomie)的细胞毒性。将微管用70% 乙醇灭菌 30 分钟,然后用杜尔贝科磷酸盐缓冲盐水 (DPBS)冲洗两次。将细胞以 1 × 105 个细胞/cm2 接种在 96 孔培养板中 , 并在 37°C 、5% CO2 Thermo Scientific Forma 系列 3)下于 200 μL 内皮细胞基础培养基(内皮生长培养基 [EGM]-2) 中孵育水 套 CO2 培养箱)。孵育 24 小时后,用 DPBS 冲洗细胞,并将细胞 暴露于含有 200 μL 培养基的 3 mg PS 微管中。仅含有培养基中的 HUVEC 的孔作为阴性对照,仅含有 EGM-2 的孔作为空白。孵育 48 小时后,除去用过的培养基,并向每孔中添加 10:1 EGM-2/CCK-8 溶液,孵育 4 小时。 4小时后,观察颜色变化,并将每孔100μL溶液 转移至新的96孔板中。对于每个实验井,都制作了技术复制品。使用 酶标仪在 450 nm 波长处测量样品的吸光度。根据以下等式,细胞活力以百分比表示:
其中 OD 代表光密度。
2.9 | 细胞附着
红色荧光蛋白 (RFP) 标记的 HUVEC 购自 Angio-Protomie。将细胞 以 5000 个细胞/cm2 的密度接种到 T-25 培养瓶中,并在 EGM-2 (SinglQuot Kit) 中生长直至 80% 汇合。为了获得更好的超声振动 性能,选择17%PS微管,在10mL 70%乙醇中超声振动2min。在生 物安全柜中蒸发乙醇24小时后,将微管与培养基混合均匀。使用 0. 25% 胰蛋白酶分离 RFP-HUVEC 细胞 1 分钟,并通过以 220 rpm 离心 5 分钟收集。细胞悬液的Z终密度为9.45×105细胞/mL。首先 将 200 μL 微管悬浮液沉积在 24 孔板上以提供 3D 结构,然后用移 液器将 150 μL 细胞悬浮液接种到微管上。将板放入培养箱中保存 4 小时,使细胞附着在微管上,然后向每孔中添加 200 μL 培养基。每 2 天更换总共 200 μL 培养基, 以Z大程度地减少培养基更换过 程中微管的损失。
3 | 结论
3.1 | 微管断裂
如图 3 所示,选择 5 个超声处理时间(0.5 、1 、1.5 、2 和 2.5 分 钟)进行微管切割。随着时间的推移,27% PS 微管和 17% PS 微管 的管长度均呈现下降趋势。尽管 27% PS 微管的平均直径 (3.50 µm ) 比 17% PS 微管 (2.08 µm) 更大,但较高的浓度使得泵送溶液进 行静电纺丝变得困难。在这种情况下,采用超声处理时间为 1 和 2分钟的 17% PS 微管进行进一步研究。超声振动1分钟和2分钟的平 均管长分别为397.16和145.42μm。
3.2 | 打印保真度和微管密度
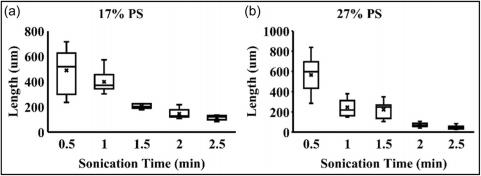
FIGURE 3(a) Boxplot of 17% PS microtube length in different sonication time. (b) Boxplot of 27% PS microtube length in different sonication time (PS, polystyrene).
为了观察细丝和合并区域,将五组打印成20×20mm的网格(图4a) 。根据管浓度(wt/vol%)和微管长度(μm)设置五组作为对照(无 微管)、0.05%长(长长度为0.05% PS微管)、0.05%短(短长度 为0.05% PS微管) ,0.1% 多头,0.1% 空头。所有五组均成功打印 出网格结构。方差分析测试还证明,微管的存在对细丝尺寸有显着影 响(p <0.0001)。微管浓度和长度均显着影响细丝尺寸,分别为p <0.0001 和 p =0.0215。网格合并区域的分析(图 5b)表明,具有较长微管或较高微管浓 度的组均对打印保真度具有显着影响,分别为 p <0.0001 和 p =0. 0003。通过比较对照组和其他组的合并区域,我们可以看到微管通 过使印刷/设计比率接近 100% 来提高印刷保真度。

FIGURE 4 (a) Bioprinted filaments (scale bar = 1 mm) (zoomed-in inc). (b) Grids merging area (scale bar = 1 mm). (c) Microtubes in bioprinting hydrogel (scale bar = 0.5 mm). (d) SEM images of hydrogels (scale bar = 200 µm). SEM, scanning electron microscopy.
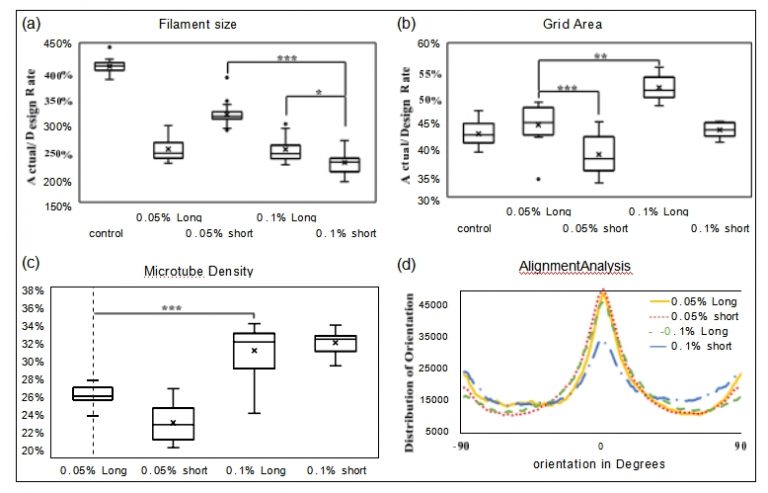
FIGURE 5 Box plots of (a) filament size, (b) grid area, (c) tube density, and (d) line plot of tube alignment analysis (*p < 0.05, **p < 0.001, ***p < 0.0001).
微管密度的显微镜图像如图4c 、d所示,统计分析结果如图5c所 示。微管浓度对微管密度有显着影响(p < 0.0001 ),而微管长度对 管密度影响不大(p = 0.4131 )。 0.1% Short 组的微管密度在五组 中Z高。这可能是由于当管浓度较高时,在打印喷嘴内更容易挤出短 微管。
所有四组微管均在复合 CMC/SA 水凝胶中显示出均匀分布的微 管。图 5d 显示微管取向的峰值位于 0 度,这表明大部分微管沿打印 方向分布高度对准。与其他组相比,0.1% 短的组的对齐水平Z低。这表明,当生物打印过程中有更多和更短的微管需要对齐时,生物打 印过程中水凝胶中的剪切应力可能无法克服微管之间的拖曳力。

FIGURE 6 Storage modulus and loss modulus of different hydrogels.
长和 0.1% 短的组,当角频率约为 60-70 rad/s 时,Gʹ 与 Gʹʹ 交叉 , 这表明这些水凝胶在高角频率下更像固体。对于对照组和 0.05% 的短路,Gʹʹ 比 Gʹ 大 100 rad/s,并且更像液体的状态导致打印网格 的保真度降低。
剪切应力-剪切速率曲线(图7a)显示剪切稀化特性,这表明随着 剪切速率的增加,非牛顿流体的粘度降低(图7b)。与其他三组相比, 0.05%长和0.1%短的组具有Z高的剪切应力和粘度,表明在生物打 印过程中具有更好的打印性能。这表明复合水凝胶具有良好的流变性 能,适合生物打印。
3.4 | 溶胀及渗透性测试
断裂。表明在合理的时间范围内具有良好的生物降解性。 0.1%短组 的肿胀率Z大,对照组大部分时间肿胀率Z小。表明具有微管的基团 可以提供水渗透的通道。
渗透率分析在 7 天的时间内进行。如图 9b 所示,7 天后所有五 组均显示渗透面积增加。对照组的通透性高于其他组。对于4个微管 组,0.05%长组的渗透性高于其他组,0.1%长组的渗透性Z小。
随着时间的增加,样品的肿胀率呈增加趋势,如图8所示。所有五组 均在前48小时内出现Z急剧的增加。 96小时时,在样品表面观察到断裂。表明在合理的时间范围内具有良好的生物降解性。 0.1%短组 的肿胀率Z大,对照组大部分时间肿胀率Z小。表明具有微管的基团 可以提供水渗透的通道。
渗透率分析在 7 天的时间内进行。如图 9b 所示,7 天后所有五 组均显示渗透面积增加。对照组的通透性高于其他组。对于4个微管 组,0.05%长组的渗透性高于其他组,0.1%长组的渗透性Z小。

FIGURE 7 (a) Shear stress-shear rate curve, (b) viscosity-shear rate curve.

FIGURE 8 (a) Swelling rate test of Day 0 (scale bar = 2 cm). (b) Swelling rate of hydrogel.

FIGURE 9 (a) Permeability test of Day 0 and 7 (scale bar = 5 cm). (b) Permeability of hydrogels.
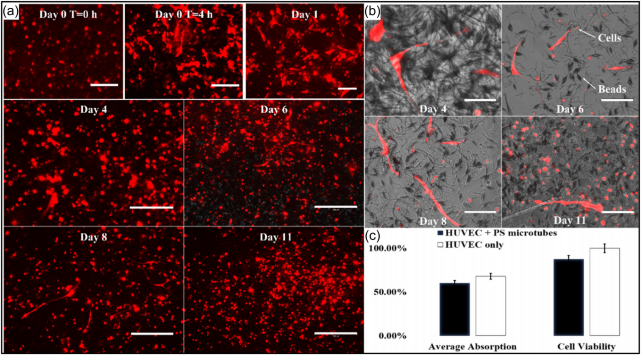
FIGURE 10 (a) RFP images for cell attachment from Day 0 to 11. (b) Overlay images for cell attachment from Day 4 to 11 (scale bar = 300 µm). (c) Biocompatibility results of PS microtubes. PS, polystyrene; RFP, red fluorescent protein.
3.5 | 生物相容性和细胞附着测试
PS微管的生物相容性测定结果如图10c所示。尽管与仅使用 HUVEC 相比,细胞活力下降至 87.31%,但活力的双样本 t 检验的 p 值为 0.2184,大于 0.05。这表明 PS 微管不会显着影响细胞活力,并且 与测试的细胞具有生物相容性。
生物相容性测试后进行细胞贴壁。通过将微管分散并混合在介质 中,使微管悬浮在介质中并形成三维结构。细胞附着的光学显微镜图 像如图10所示。孵育4小时后,细胞开始附着到微管上。这种初步的 细胞培养表明,微管为 HUVEC 细胞提供了附着,它们可用于潜在的 毛细管支架。
4 | 讨论
在本文中,我们将静电纺丝微管与 CMC/SA 水凝胶结合起来,用于 生物打印支架的血管化。这项研究不同于传统的混合生物打印,即在 生物打印结构的每一层中插入静电纺丝垫(Naghieh 等人,2017 年 ; Vyas 等人,2020 年)。微管通过超声波振动破碎并均匀分散在 复合生物墨水中。该方法显示了制造过程的简单性、支架孔隙率的均 匀性以及支架的多向血管化潜力。
水凝胶本质上是粘弹性的,可以通过改变聚合物或交联剂浓度来 调节材料的粘弹性(Mattei et al., 2017)。当一个聚合物链与另一 个聚合物链连接并形成更大的链或网时,就会发生交联过程(Lopez Hernandez 等人,2021 )。较长的聚合物链缠结并增加溶液粘度。
在未交联的水凝胶中添加微管将增加水凝胶的整体密度和粘度。从喷 嘴挤出时,一些微管会相互缠结,因此有助于保持水凝胶的形状保真 度。生物打印过程结束后,微管-水凝胶界面的剪切应力会将水凝胶保 持在一起,这减少了未交联水凝胶的液体流动效应, 同时仍然适合挤 出。考虑到微管与水凝胶相比是固体,水凝胶中较高的微管密度将导 致在相同的时间和打印压力下挤出更少的水凝胶,与3D模型相比减少 了过量的水凝胶挤出。
作为非牛顿液体,复合CMC/SA水凝胶从喷嘴挤出后会延伸,导 致细丝尺寸大于喷嘴尺寸。随着微管混合在复合水凝胶中,复合生物 墨水的整体粘度增加,转变为更固体的状态。图 5 显示,微管浓度和 长度对打印结构中的细丝尺寸、合并面积和微管密度有显着影响。更 高的浓度和更短的微管可以更好地与复合水凝胶结合,Z大限度地提 高其对生物墨水流变特性的影响。与 0.05% 短的组相比,0.05% 长 的组显示出接近 100% 的比率,表明微管浓度和长度之间存在交互作 用。
然而,浓度较低和微管较短(短0.05%)的组在五组中表现出Z低的 网格面积比。这表明微管长度和浓度对细丝合并具有交互影响。一种 可能的解释可能是由于复合生物墨水的挤出量较高,导致合并面积增 加。图 5c 显示,较高的浓度和较短的微管会导致打印结构中微管密 度的增加,其中 0.05% 短组显示密度Z低。人们认为,微管浓度比 微管长度起着更重要的作用,并且较短的微管浓度越高,印刷结构中 的微管密度就越高。
流变特性解释了水凝胶生物打印过程的本质。较高的储能模量 (Gʹ ) 表明水凝胶需要更大的能量来扭曲样品结构,较高的损耗模量 (Gʹʹ) 表明水凝胶具有存储更多能量的能力 (Zin et al., 2019)。在图 6 中 , 对照组和 0.05% 短组的 Gʹʹ 高于 Gʹ , 表明其行为更像液体。 0.05 %长和0.1%短的组具有更高的Gʹ 、Gʹʹ、剪切应力和粘度,表明比其他 组更好的印刷保真度。 0.05% 长、0.1% 长和 0.1% 短组在较高角频 率(大约 60-70 rad/s)下转变为更接近固体的状态。我们还可以看 到,随着微管浓度和长度的增加,随着角频率的增加,水凝胶的液体 到固体的转变发生得更早。图 5a 证实了与对照组相比,这两组的灯 丝尺寸和网格面积有所改善。然而,剪切稀化特性表明,3% CMC/1 % SA 的复合水凝胶可能不是理想的生物打印材料,尽管具有增加水 凝胶粘度的好处。
微管的添加对复合生物墨水的膨胀和渗透性能有显着影响。在图 8中,在96小时内,与对照组相比,所有微管组都表现出更高的膨胀 率,其中0.1%短组显示出明显更高的膨胀率,这可能是由于较短的微 管提供的微通道增加,促进了流体流动和膨胀的增强。在图 9 中,所 有组都表现出良好的渗透性,使它们成为未来细胞培养应用的有希望 的候选者。然而,与对照组相比,所有微管组均表现出较低的渗透性 , 并且更长和更高浓度的微管对降低渗透性的影响更显着。在这两个 参数中,微管浓度似乎对渗透性的降低起着更重要的作用。这表明固 态微管可能会通过阻塞高微管密度和长度的渗透通道而对支架产生不 利影响。因此,在未来的细胞培养中,Z小化微管长度并优化水凝胶 支架中的微管密度非常重要。
体外实验表明电纺PS微管与HUVEC细胞具有生物相容性。培养基 中分散的微管被悬浮,并在 3D 空间中提供了更大的空间和高体积重 量比, 以实现更好的细胞附着和增殖。如图 10a 所示,4 小时后,HUVEC 细胞从圆形变为条形,并在 3D 空间中跨越不同的微管。几天后,一些细胞成功地扩展到多个微管, 同时与其他细胞建立了通讯 。结果表明PS微管具有促进细胞增殖和分化的潜力。
5 | 结论
简而言之,本研究研究了同轴静电纺丝微管在毛细血管化复合生物打印过程中的潜力。通过打印水凝胶中均匀分散的微管以及可调节的微 管长度和浓度,我们的团队能够制造具有微尺度通道和可控宏观几何 形状的混合仿生血管化支架。我们的结果表明,静电纺丝微管的添加 对打印丝尺寸和打印保真度有显着影响。此外,水凝胶中的微管浓度影响印刷水凝胶内的微管密度。在五个组中,0.1%长的组具有较高的 微管浓度和较长的长度,显示出zuihao的生物打印结果。此外,0.1%短 组的膨胀率Z高,对照组的渗透性zuihao。 PS 微管与 HUVEC 细胞兼容,具有毛细血管化的潜力。未来的工作将集中于交联水凝胶细胞培养和生物打印过程中微管运动的模拟。还将研究与 5-10μm 的天然人 体毛细血管尺寸一致的更大微管的制造。
-
- Cellink 生物3D打印机 BIO X
- 品牌:瑟林克
- 型号:BIO X