| 行业应用: | 制药/化妆品 药品包装材料 |
注射药物中不溶性微粒来源以及对患者风险的评估(中)
塑料容器中的颗粒
塑料颗粒污染一般产生于使用尖锐物体通过注射口或来源于塑料输液器中。将针头插入药瓶或输注容器的隔膜或塞子可能会从隔膜或塞子上分离出碎片。该颗粒可能漂浮在注射液中。如果碎片很小或被遮盖(例如标签或彩色小瓶),则污染可能无法被检测到并被吸入注射器中从而注射到患者体内。
注射器具中的颗粒
输液在中国是Z常见的治疗方式,有研究显示,中国每年一次性输液器的使用量就超过50亿支。这些输液器是不是真的安全?2017年全国上报的医疗器械不良事件报告中,一次性使用输液器发生的不良事件上报了4.35万份,占总数的11.57%,是中国出现问题Z多的一种医疗器械。因此输液器的制造必须防止颗粒污染。中国药典对此也有着明确的要求。输液器中使用的医疗器械(如管道或导管)中的微粒也可能会对患者的健康造成不利影响,患者在输液过程中可能会因器械自身释放的微粒而面临污染风险。为此,美国FDA制定了在医疗器械生产过程中,10–25µm的颗粒回收率至少为90%,≥25µm的颗粒回收率Z低为80%的验收标准。有论文分析了输液和血液透析用导管的微粒污染水平。实验将无颗粒水注入管道,并在不同的采样时间检测颗粒污染。无颗粒水通过不同孔隙度(0.8µm、0.45µm和0.22µm)的过滤器。观察到器械的初始颗粒污染,但对输注药物溶液的颗粒污染影响有限。
目前仍没有统一的标准来规定无菌医疗器械和初包材的微粒污染检测方法,对于一次性使用的输液器等血路产品,国有标准采用冲洗内腔液体通道表面,然后收集冲洗液机型薄膜过滤,并在显微镜下进行检测的方法,如GB 8368 2005一次性使用输液器-重力输液式,GB 19335-2003 一次性使用血路产品通用技术条件,USP 788专门用于注射和非肠道输液,可能并不总是适用于医疗器械。
静脉注射液的微粒污染源于药物的不完全重组、静脉注射治疗期间的药物不相容反应或输液系统中的部件颗粒,很多研究在对输液管终端连接处的样本进行分析时发现不同数量的塑料颗粒。
预填充玻璃注射器中的润滑剂(硅油)也可能会导致蛋白质聚集,从而产生颗粒。硅树脂注射器中L-天门冬酰胺酶的重组诱导蛋白质聚集。各种技术可用于测量蛋白质配方中的颗粒数量,但它们不足以表征各种蛋白质溶液中的颗粒。硅化过程可能会影响预填充注射器中蛋白质制剂中颗粒的产生。在抗体制剂中添加一定浓度的表面活性剂可减少预充玻璃注射器中的颗粒形成。
药物溶液中的未溶性固体
药物溶液中未溶解的固体是微粒污染的另一个来源。在新生儿重症监护病房,一项研究表明,万古霉素注射器给药剂量的变化主要是由重组粉剂时使用的溶剂和未系统地进行搅拌使粉剂完全溶解导致的。通过静脉药物集中调配中心(CIVAS)对静脉用药进行改良,保证了注射即用型药物的微生物质量和化学稳定性,有助于医院患者医疗服务的的质量和高效管理
治疗性蛋白质产品还可能含有产品固有的颗粒。这些固有的“蛋白质”颗粒通常不同于传统的“外来”颗粒,更难以检测和计数。需要监测治疗性蛋白质产品中的所有(外来和固有)微粒,这导致了测量技术的发展。工业案例研究说明了如何制定亚可见颗粒分析策略,以评估颗粒物质的性质和数量,从而更好地开发药物产品或进行稳定性研究。胤煌科技(YinHuang Technology)旗下拥有一系列拥有自主知识产权的颗粒检测设备如MIP系列,FIPS系列等和多种可见异物检查设备以及纳米粒度仪等,让您在医药,材料,化妆品以及半导体等领域的颗粒检测如虎添翼,部分机型以及技术参数下图
MIP系列不溶性微粒检测仪 FIPS系列流式动态图像法粒度仪


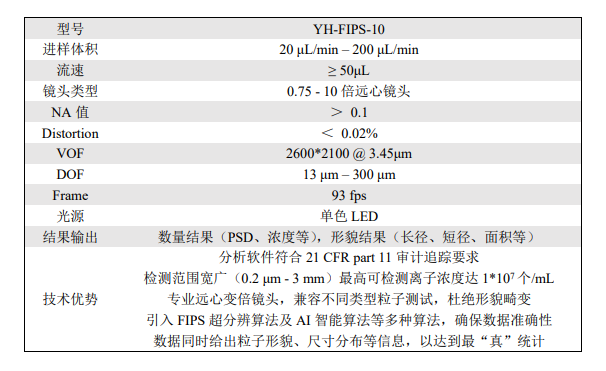

胤煌科技(YinHuang Technology)是一家专注于为医药、半导体及化工材料等行业提供检测分析设备及技术服务的高科技公司,致力于为客户提供全面、准确的检测分析和解决方案。主营产品包括不溶性微粒分析仪,可见异物检查分析仪,原液粒度及Zeta电位分析仪,CHDF高精度纳米粒度仪,高分辨纳米粒度仪,溶液颜色测定仪,澄清度测定仪等,公司自主研发的YH-MIP系列显微计数法不溶性微粒仪、YH-FIPS系列流式动态图像法粒度仪,YH-FIPS系列微流成像颗粒分析仪已经在生物医药、半导体及材料化工领域得到广泛应用.


上海胤煌科技有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒