昆虫表达服务实验流程
2023-07-31435一、昆虫表达系统概述
昆虫表达体系是四大蛋白表达系统(原核细胞,酵母,昆虫细胞,真核哺乳动物表达体系)之一。昆虫表达系统的原理是通过将转移载体中的表达组件转座到大肠杆菌中增殖的杆状病毒穿梭载体上,提取穿梭质粒DNA转染昆虫细胞后,得到的子代病毒即为重组病毒。将病毒上清侵染昆虫细胞,获得表达的重组蛋白。
二、 昆虫表达系统实验流程
1. 把目的基因克隆至pFastBac系列载体产生重组质粒
根据pFastBac系列载体的多克隆位点选择合适的酶切位点,按照读码框插入目的基因序列。通过测序验证插入序列是否正确。
2. 转化DH10Bac大肠杆菌
转化pFastBac重组质粒到DH10 Bac大肠杆菌中,37℃培养48小时。可以选择pFastBac1-EGFP作为对照质粒。转化后利用蓝白斑筛选重组菌株。重组菌株由于转座会导致LacZ基因的破坏而呈现白斑,用于蓝白斑筛选的LB琼脂糖平板应含有50 μg/ml卡那霉素,7 μg/ml庆大霉素,10 μg/ml四环素,40 μg/ml X-gal和40 μg/ml IPTG。
3. 阳性验证(选做)
挑取白斑,重新划线以确认获得的白色克隆是真实的白斑。平板含有50 μg/ml卡那霉素,7 μg/ml庆大霉素,10 μg/ml四环素,40 μg/ml X-gal和40 μg/ml IPTG,37℃培养过夜。
挑取白斑,培养过夜。须使用含有50 μg/ml卡那霉素,7 μg/ml庆大霉素和10 μg/ml四环素的LB培养液。
5. 重组bacmid质粒提取
小量抽提试剂盒提取重组bacmid DNA。重组bacmid DNA应该分装冻存于-20℃,因为反复冻融会导致bacmid断裂等从而显著降低其转化效率。如两星期内使用,可保存于4℃。
6. 重组bacmid的PCR鉴定
利用 PCR反应对阳性克隆进行进一步的验证。PCR 反应所用引物为pUC/M13 forward primer (5'-CCCAGTCACGACGTTGTAAAACG-3'),和pUC/M13 reverse primer (5'-AGCGGATAACAATTTCACACAGG-3')。没有发生转座的bacmid其所扩增所产生的片段长度为350bp,重组bacmid扩增所产生的片段的长度为350bp加上插入片段的长度。
7. 重组bacmid转染昆虫细胞
将提取的重组Bacmid转染进入昆虫细胞,转染后,28℃培养24小时,细胞和细胞核开始变大;转染后24-72小时,细胞慢慢停止生长、脱落,细胞表面长出芽孢状结构;转染后72小时候细胞开始裂解,此时病毒开始释放到培养液中。如果同时转染了pFastBac1-EGFP,在转染72小时后可以观察到大部分细胞呈现绿色荧光,转染后96小时几乎所有的细胞都呈现绿色荧光,这样可以作为整个病毒包装体系的阳性对照。
8. 收集P1代杆状病毒
转染96小时后,收集培养液上清,500g离心5分钟以沉淀细胞和细胞碎片,取上清即为P1代杆状病毒。此时病毒滴度通常为1X106-1X107 pfu/ml。P1代病毒可短期保存于4℃,或分装于含2% FBS的培养液中后在-80℃较长期保存。反复冻融会大大降低病毒活力,其滴度有可能降低10至100倍。
9. P1代杆状病毒的扩增
P1代病毒再次感染昆虫细胞可获得P2代病毒。如果采用悬浮培养的昆虫细胞进行病毒扩增,建议使用10 ml培养液并且控制细胞密度为2X106/ml;如果使用6孔板贴壁培养的细胞进行扩增,细胞密度应为2X106/well,MOI (multiplicity of infection)为0.05-0.1(即每100个细胞用5-10 pfu的病毒进行感染)。28℃培养48-72小时后,70-80%的细胞死亡时,收集细胞和上清,500g离心5分钟,取上清即为P2代病毒。此时病毒滴度约为1X107-1X108 pfu/ml。可收集本步骤离心后的细胞碎片沉淀,加入适量的1X SDS-PAGE蛋白上样缓冲液,裂解后进行SDS-PAGE凝胶电泳及Western blot检测,以分析确定目的蛋白是否已经正常表达。
10. 病毒感染昆虫细胞进行目的蛋白的大规模表达
可选择Sf9/Sf1/HighFive的任何一种细胞株进行蛋白大规模表达。但如果表达的是分泌蛋白,建议选用HighFive。建议在昆虫细胞的对数生长期进行病毒感染,此时细胞密度在1X106/ml-2X106/ml为佳,MOI可从5-10开始尝试。建议在不同的时间阶段,如感染后24、48、72或96小时收集细胞,裂解细胞,SDS-PAGE并进行Western Blot检测以确定最佳的停止蛋白表达的时间。因为昆虫细胞内有很多蛋白酶,表达时间过长会导致目的蛋白的降解。分泌蛋白的表达高峰通常在感染后30-72小时,而非分泌蛋白的表达高峰通常在感染后48-96小时。
11. 目的蛋白的纯化
利用pFastBac1进行目的蛋白的表达的时候,根据蛋白纯化方式的需要以及融合表达目的蛋白以提高其表达量的需要,可以在质粒构建时添加His标签或GST标签。为了防止额外添加的His和GST等蛋白标签影响目的蛋白的生物学功能和结构研究,可在融合蛋白和标签之间添加蛋白酶酶切位点,如TEV或PreScission的酶切位点。如果蛋白主要以可溶形式表达,离心收集昆虫细胞,超声裂解细胞,但由于昆虫细胞内蛋白酶种类比较多,需要添加各种蛋白酶抑制剂。离心收集超声后上清,使用镍柱或GST柱等纯化目的蛋白。同时可以利用离子交换、分子筛层析等进一步纯化目的蛋白。纯化获得的蛋白,可以添加适量甘油后保存,或者如果有需要也可以适当浓缩后保存等。
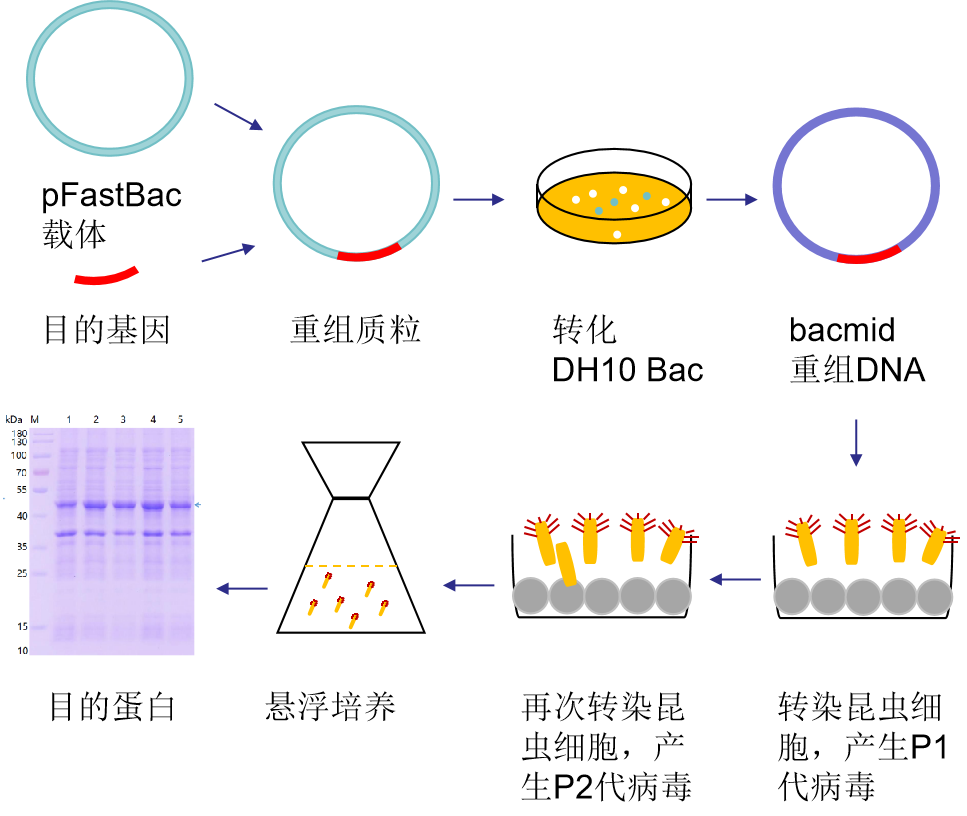
图1 昆虫表达系统实验流程
三、昆虫表达系统的优缺点
优点:
1. 外源基因表达水平高、易于表达异源多聚体蛋白、安全性高。
2. 重组表达的蛋白产品具有正确的翻译后修饰和生物学活性,如二硫键的形成、磷酸化、糖基化等等。
3. 相对于哺乳动物细胞蛋白表达系统,蛋白昆虫表达体系所生产的蛋白,糖基化程度偏低。但是昆虫蛋白表达系统的优势在于,利用病毒进行转染,操作相对容易,转染体系容易形成(相对哺乳动物瞬时转染体系)。
4. 可容纳大分子的插入片段。
5. 昆虫细胞悬浮生长,容易放大培养,有利于大规模表达重组蛋白。
6. 易于表达异源多聚体蛋白,可通过多种重组病毒同时感染昆虫细胞或用含有多个表达框的一种病毒感染昆虫细胞来实现
缺点:
外源蛋白表达处于极晚期病毒启动子的调控之下,这时由于病毒感染,细胞开始死亡。
四、昆虫表达系统的应用
1.作为超高效的真核基因表达载体,生产有用的工程蛋白
2.作为基因工程病毒杀虫剂,提高害虫防治效率
3.研究杆状病毒基因组的结构与功能
4.研究真核基因表达的调控机制
五、卡梅德生物提供完整的昆虫表达服务
卡梅德生物拥有完善的昆虫表达纯化体系,昆虫细胞蛋白表达系统适合于膜蛋白的重组表达,4次及以下跨膜蛋白几乎可以有效地在昆虫细胞中进行表达和纯化。膜蛋白的纯化是一件比较耗时耗力的事情,卡梅德生物科技可以提供纯度高纯度的全长膜蛋白定制产品。我们可以为客户提供整套的蛋白表达方案,我们免费对客户提供的基因进行序列分析检测;同时根据Sf9,Sf21,Hi-5及S2昆虫细胞的密码子偏爱性,免费为您进行密码子优化,从而有效提高重组蛋白表达量,为您提供一站式服务。如需提供昆虫表达纯化帮助,请浏览卡梅德生物科技有限公司网站。
-
- 重组蛋白昆虫表达服务
- 品牌:卡梅德
- 型号:重组蛋白昆虫表达服务


