基本的电化学腐蚀测量
2021-03-0614269介绍
大多数金属腐蚀通过在金属与溶液界面上发生的电化学反应而产生。对大气腐蚀而言金属表面薄的水分子层形成了溶液。大桥中的钢筋发生腐蚀的电解液是潮湿的混凝土。尽管大多数腐蚀发生在水中,也有腐蚀发生在非水系统中。
腐蚀通常以正、逆反应达到平衡时的速率发生。首先是阳极反应,金属被氧化,释放离子至金属表面。另一个是发生阴极反应,溶液中的离子(通常是O2 或 H+)被还原,吸收了来自金属的电子。当这两个反应达到平衡时,每个反应的电荷转移速度相等,没有净电流产生。正、逆反应可发生在同一金属或两种不同金属接触。
图1-1是上述过程的图解。纵轴是电位,横轴是电流的对数。理想的阴、阳极反应电流如图中直线所示。曲线表示总电流—阴极电流和阳极电流之和。这是在用恒电位仪进行电位扫描时测得的电流。图像中的尖点就是电流发生改变的地方,即反应从阳极反应转变成阴极反应或是阴极反应转变成阳极反应。尖点是由于将横轴对数化造成。横轴对数化是必要的,因为在一个腐蚀试验中,较宽范围内的电流值需展示在图中。由于钝化现象,电流值改变6个数量级不常见。
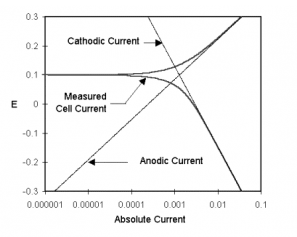
图1-1 腐蚀过程中阳极和阴极电流部分
金属电位是阳极和阴极反应平衡时的电位。参照图1-1。注意每个半反应的电流取决于金属的电化学电势。假设阳极反应产生过多电子只金属表面。过剩电子使得金属电位向负向移动,减缓阳极反应,加快阴极反应。这抵消了系统中的初始扰动。
在大多数腐蚀电化学试验中,步就是测量开路电位。开路电位和腐蚀电位的关系通常可互换,但是更偏向于开路电位。
腐蚀科学家在测量开路电位很重要的一点就是在进行试验前给予足够时间使得开路电位达到稳定状态。稳定的开路电位表示所要研究的系统处于稳定状态,即各种腐蚀反应的速度恒定。有些腐蚀反应在很短时间内达到稳定状态,有些需要几个小时。不管所需多少时间,电脑控制系统可以检测开路电位使得测试在其稳定后进行。
开路电位时的阳极电流或阴极电流叫做腐蚀电流Icorr。如果可以测得腐蚀电流值,就可用其计算出金属的腐蚀速率。但是腐蚀电流不能直接测得。然后,它可用电化学技术得到估算结果。在任何真实体系中,Icorr和腐蚀速率是包含多个系统变量的函数,包括金属类型,溶液组成,温度,溶液运动,金属浸入溶液的时间,以及许多其他变量。
上述描述的腐蚀过程没有提到金属表面的状态。实际上,许多金属腐蚀后在其表面形成氧化物层。如果氧化层可YZ腐蚀进一步发生,则称为金属的钝化。一些情况下,钝化从局部破化使得在很小地方金属发生明显腐蚀。这种现象叫点蚀。
由于腐蚀通过电化学反应发生,电化学技术是一种理想的研究腐蚀过程的方法。在电化学研究中,用几个平方厘米表面积的金属试样来模拟在腐蚀系统中的金属。将金属样品浸入到与真实金属腐蚀环境相似的溶液中。附加电极也浸入溶液中,所有电极连接到恒电位仪。恒电位仪可以控制改变金属试样的电位,测得电流。
控制电位(恒电位)和控制电流(恒电流)极化都很有用。当发生恒电位极化时,可测得电流,当发生恒电流极化时,可测得电位。这部分讨论集中在控制电位模式,控制电位比控制电流更加常用。 除了开路电位对时间,电化学噪声,电偶腐蚀和一些其他方法外,恒电位模式用于给腐蚀平衡过程施加扰动。当金属试样在溶液中的电位偏离开路电位时,被称为试样的极化。此时测得试样的电流响应。这一响应过程可用来研究试样的腐蚀行为。
假设用恒电位仪将电位极化至阳极区(开路电位正方向移动),看上述图1-1。这将加快阳极腐反应速率(腐蚀),减小阴极腐蚀速率。因阳极反应和阴极反应速率不再相等,净电流从电子电路流向金属试样。按照惯例这一迹象的电流叫正电流。关于电化学现象的惯例,可见此文件结尾部分。
如果将电位极化至足够远离开路电位,阴极反应电流可忽略不计,测得的电流即是阳极反应电流值。在图1-1中,注意真实电流曲线和阳极电流在正无穷电位时位于彼此高处。相反,在负无穷电位时,阴极电流在整个电流中占主导地位。
在某些情况改变电位,首先使金属钝化,然后引起点蚀。测得电流对电位或对时间可以判断在腐蚀电位下的腐蚀电流,发生钝化的倾向,或者发生点蚀的电位范围。
由于测量低腐蚀速率的能力以及进行试验测量的速度优势,电化学方法在研究腐蚀现象中的广泛运用,使得电化学腐蚀测试系统在现代腐蚀实验室中形成一个标准。
腐蚀定量理论
之前部分已指出腐蚀电流不能直接测得。许多情况下,可以从电流对电压数据来估算腐蚀电流。在1.5V范围内可以测得对数化电流对电位曲线。相对于开路电位进行电位扫描。将所测数据按腐蚀过程的理论模型来拟合。
假设发生在金属表面反应的阳极和阴极过程均由电荷转移动力学控制。这是腐蚀反应的通常情况。动力学控制的电化学反应遵循等式1-1 Tafel等式。
![]()
I =反应电流
I0 =交换电流
E =电极电位
E0 =平衡电位
β = Tafel常数(V)
Tafel方程描述的是一个孤立反应的行为。在腐蚀系统中,发生两个正逆反应—阳极和阴极
在腐蚀系统中阳极和阴极反应的Tafel方程可结合成Butler-Volmer(式1-2)
![]() Equation 1-2
Equation 1-2
I =测试电流
Icorr =腐蚀电流
E =电极电位
Eoc =腐蚀电位
βa =阳极Tafel常数
βc =阴极Tafel常数
从式1-2中可以得到关于电流对电位曲线的什么信息?在开路电位时,每个指数等于1,因此与预期结果一致,测得电流值为0。开路电位附近的指数组成总电流。后,在恒电位仪控制下,电位远远偏离开路电位,其中一指数占主导地位,另一指数可忽略。此时,lgi和E之间呈线性关系。
Lgi对E图称作Tafel图。图1-1的Tafel图可从Butler-Volmer关系直接得到。注意真实电流曲线线性区的范围。
实际上,许多腐蚀体系是由动力学控制,因此服从等式1-2关系。在所研究的体系中,反应由动力学控制,lgi对E的曲线中在Ecorr的两个方向都有线性区。然后,也存在复杂的情况,如:
1.浓差极化,反应速率由反应物到达金属表面的速率控制。在电流较大时,当溶液中氧气或氢离子的扩散速度没有足够快已保证动力学过程是控制反应速率,阴极反应表现出浓差极化现象。浓差极化更直观的叫法是扩散控制。
2.氧化物的形成,可能或可能不导致钝化层的形成,改变了金属试样的表面状态。原始表面和改变后的表面可能会有式1-2中不同的常数。
3.引起表面状态改变的还有如一种合金成分优先溶解的现象,也可以引起问题。
4.不止一个阴极反应或阳极反应的混合控制过程,反应同时发生使得模型变得复杂。混合控制的其中之一的例子就是同时发生氧气和氢离子的还原过程。
5.后,在动力学控制模型下,电流流经溶液产生的电位降会引起错误。这一问题可以通过对恒电位仪通过IR补偿进行校正。关于IR补偿的讨论,可以看Gamry关于IR补偿的应用报告。
在大多数情况下,上述列举的例子会引起Tafel图没有线性区。这一现象应予以重视。
经典的Tafel分析法是将lgi对E图中线性区外推至交点。如图1-2所示。交点处的阳极电流或阴极电流值就是腐蚀电流值。但是,真实腐蚀体系中不能提供足够的线性区来进行准确的外推。现在大多数腐蚀测试软件,如Gamry的DC105软件,进行更加复杂的数值拟合至Butler-Volmer等式。通过调节Ecorr, Icorr, βa , and βc值将所测数据拟合至Butler-Volmer关系。这一拟合方法的优点是不需要足够大的线性区域。
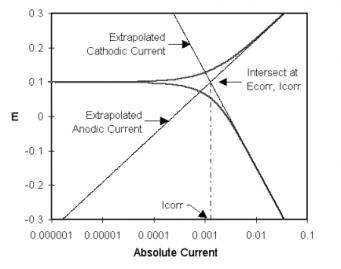
图1-2 经典Tafel曲线分析
极化电阻
如果E非常接近于开路电位,则式1-2可以进一步简化。接近开路电位时,电流对电位曲线可近似为直线。这一直线的斜率是电阻(欧姆)。因此此斜率称为极化电阻Rp。由极化电阻值和Tafel系数经验值可估算出腐蚀电流值。
如果将式1-2中的指数用幂级数展开项的前两项近似替代并简化,可以得到Stern-Geary公式:
 Equation 1-3
Equation 1-3
在极化电阻试验中,在接近开路电位的范围进行电位扫描(± 10 mV),记录电流对电位曲线图。在此范围进行数据拟合可得到极化电阻值Rp。
极化电阻数据得不到Tafel系数相关信息。因此,要使用式1-3必须要知道Tafel系数。Tafel系数可由Tafel图得到或可由经验估算得出。
腐蚀电流计算腐蚀速度
通过拟合腐蚀数据获得的数值结果就是腐蚀电流。腐蚀速率更加常用,如mm/a。腐蚀电流怎样得到腐蚀速率?假设一溶液中电解反应涉及到一种化学物质,S:
![]()
可通过法拉第定律将电流和质量联系在一起。
![]() Equation 1-4
Equation 1-4
Q=反应产生的电量
n=电荷转移数
F=法拉第常数
M=反应物摩尔数
式1-4更常用的形式运用到当量这一概念。当量是指反应物反应1摩尔电子的质量。对于原子种类来说,化学当量EW=AW/n(AW是原子质量)
得到M = W/AW,带入式1-4得到:
![]() Equation 1-5
Equation 1-5
W是反应物质量
某系情况如金属表面发生均匀腐蚀,腐蚀速率可用年单位来计算。注意,这一计算方法只适用于均匀腐蚀,当产生局部腐蚀时,这一方法得到的结果会大大低估问题!
对于一复杂合金发生均匀溶解时,此时的当量是每个合金成分当量的平均值。摩尔分数作为权重因子,而不是质量分数。如果发生不均匀溶解,可通过检测腐蚀产物来计算当量。
失重可简单地转换为腐蚀速率。需要知道密度d,试样面积A。电量Q可通过Q=IT得到,T是时间(秒),I是电流。代入法拉第常数。则将式1-5变为:
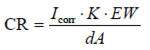 Equation 1-6
Equation 1-6
CR=腐蚀速率(mm/a)
Icorr=腐蚀电流(A)
K=常数
EW=当量(g/当量)
d=密度(g/cm3)
A=面积(cm2)
表1-1显示的是式1-6中选择不同腐蚀速率单位的常数K的数值。
Table 1-1. Corrosion Rate Constants
Corrosion Rate Units | K | Units |
mm/year (mmpy) | 3272 | mm/(amp-cm-year) |
milli-inches/year (mpy) | 1.288x105 | Milli-inches(amp-cm-year) |
参考ASTM G102做更深入了解。
IR补偿
当电流经过两个电极之间的导电溶液时,会引起溶液各部分电位分布差异。电位的整体变化与电极表面非常接近。这里电位梯度主要由于电极表面附近产生的浓度梯度。也有电流经过溶液电阻产生的电位降。
在电化学试验中,希望控制或测得的电位是工作电极相对于参比电极的电位。通常不会注意溶液电阻引起的电位降。
和所有现代电化学仪器一样,Gamry Series G或Reference 600都是三电极体系恒电位仪。测试和控制的是没有电流经过的参比电极和其中之一电流流经的电极(工作电极)之间的电位差异。另一电流流经的电极(对电极)引起的电压降没有关系。
注意参比电极的放置位置对电流经过溶液电阻产生的电位降的影响。将参比电极看作在溶液中不同位置对电位进行采样。离工作电极越近,由IR降引起的误差越小。然而,由于电极有限的尺寸,在实际情况在并不能通过放置参比电极在溶液中的位置来完全补偿IR降。电池电阻除放置参比电极外剩余的称为未补偿电阻Ru。
Gamry恒电位仪采用电流中断IR补偿法来随时修正未补偿电阻带来的误差。电流中断技术中,周期性的快速关闭一下电流。溶液中没有电流经过时,IR降也随之消失。电极表面的电位降在一个快速时间范围内保持常数。有电流经过和没有电流经过之间电位的差异就是未补偿IR降。
每次获取一个数据点时恒电位仪都会直接控制电流中断。实际上有3个电位读数: 电流被关闭之前的电位E1,电流关闭后的电位E2和E3。如图1-3所示。由后两个电位值推断电位差值ΔE,回到电流被中断的那一瞬时。中断的时间取决于电流。大电流范围时,中断时间为40微秒。低电流范围时,中断时间持续长一点。

图1-3 电流中断时电位对时间图
在控制电位模式中,有几种方法可使施加电位随时修正IR误差。简单的方法就是,采用上一个点的IR误差来修正下一个点。例如,如果希望无IR降的电位是1V,上次测得的IR误差是0.2V,恒电位仪则会施加1.2V电位。这一方法就是用上个点测得的误差来修正下一点的施加电位。除了这一常用的补偿模式外,Gamry PC4还提供取衰减曲线上两个数据点的平均值这一更为复杂的反馈模式。
默认控制电位模式,通过电流中断法修正施加电位测得电位误差。在控制电流模式,则不需要修正。如果选择IR补偿模式,会从测得的电位中减去IR误差。因此,所有记录的电位都没有IR误差。
关于未补偿电阻详细的理论研究可查看Keith B. Oldham et al, Analytical Chemistry, 72, 3972 & 3981(2000)
电流和电压的约定
在电化学试验中电流的极性可以不一致。对于不同领域电化学研究者或不同国家甚至不同恒电位仪,-1.2mA的电流在意义都不一样。对电化学分析家来说意味着1.2mA的阳极电流。对于腐蚀科学家来说意味着1.2mA的阴极电流。Gamry的恒电位仪默认的是腐蚀领域的公约,正电流表示阳极,负电流表示阴极。为了方便全世界用户,Gamry恒电位仪可以通过简单改变软件命令来提供你偏爱的电流极性。
电位的极性也会产生混乱。在电化学腐蚀测试中,平衡电位可假设为开路电位。我们保留了腐蚀电位Ecorr这一项,也就是电化学测试中没有电流流过时由电流对电位数据的拟合而定。理想情况下,Eoc 和Ecorr是完全相同的。在扫描过程中电极表面的改变会引起这两个数值的差异。
大多数恒电位仪,所记录的电位都是相对于参比电极或开路电位的电位。前者表示为"vs. Eref",后者表示为"vs. Eoc"。将一种形式的电位改变为另一种的公式是:
E vs. Eoc = ( E vs. Eref) - Eoc
E vs. Eref = ( E vs. Eoc) + Eoc
不管是相对参比电极还是相对应开路电位,只使用其中一种。电位越正,阳极极化越严重,加速工作电极的氧化过程。相反,负电位加速还原反应。
腐蚀理论和电化学腐蚀测试的参考文献
DC Electrochemical Test Methods, N.G. Thompson and J.H. Payer, National Association of Corrosion Engineers, 1440 South Creek Drive, Houston, TX 77084-4906. Phone: 281-228-6200. Fax: 281-228-6300. ISBN: 1-877914-63-0. Recommended!
Principles and Prevention of Corrosion, Denny A. Jones, Prentice-Hall, Upper Saddle River, NJ 07458 (1996). ISBN 0-13-359993-0. Recommended!
Polarization Resistance Method for Determination of Instantaneous Corrosion Rates, J. R. Scully, Corrosion,56, 199 (2000)
Several electrochemical techniques have been approved by the ASTM (American Society for Testing and Materials, 100 Barr Harbor Drive, West Conshohocken, PA 19428. Phone: 610-832-9500. Fax: 610-832-9555, www.astm.org). They may be found in Volume 3.02 of the ASTM Standards:
G 5: Potentiostatic and Potentiodynamic Anodic Polarization Measurements
G 59: Polarization Resistance Measurements
G 61: Cyclic Polarization Measurements for Localized Corrosion Susceptibility of Iron-, Nickel-, and Cobalt-Based Alloys
G 100: Cyclic Galvanostaircase Polarization
G 106: Verification of Algorithm and Equipment for Electrochemical Impedance Measurements
G 108: Electrochemical Potentiokinetic Reactivation (EPR) for Detecting Sensitization
Electrochemical Techniques in Corrosion Engineering, 1986, National Association of Corrosion Engineers, 1440 South Creek Drive, Houston, TX 77084-4906. Phone: 281-228-6200. Fax: 281-228-6300.
Corrosion Testing and Evaluation, STP 1000, Edited by R. Baboian and S. W. Dean, 1991. American Society for Testing and Materials, 100 Barr Harbor Drive, West Conshohocken, PA 19428. Phone: 610-832-9500. Fax: 610-832-9555. ISBN 0-8031-1406-0.
Electrochemical Corrosion Testing, STP 727, Edited by F. Mansfeld and U. Bertocci, 1979. American Society for Testing and Materials, 100 Barr Harbor Drive, West Conshohocken, PA 19428. Phone: 610-832-9500. Fax: 610-832-9555.
Corrosion and Corrosion Control, 3rd. Ed., Herbert H. Uhlig, John Wiley and Sons, New York, 1985.
-
- Gamry电化学工作站 Reference 600+
- 品牌:美国Gamry电化学
- 型号:Reference 600+


