利用混沌微混合器理解微流控器件中脂质纳米颗粒的形成机制
2024-04-2390脂质纳米颗粒(LNPs)或脂质体是纳米药物中Z广泛使用的药物载体。LNPs的大小是影响药物递送效率和治疗效果的重要因素之一。本文利用微流控装置研究了脂质浓度和混合性能对LNP大小的影响,旨在了解LNP形成机制并精确控制LNP大小。我们制作了混沌微混合器结构深度为11 μm和31 μm的微流控装置。根据LNP形成行为结果,通过使用低浓度的脂质溶液和配备31 μm混沌微混合器结构的微流控装置,我们能够生产Z小尺寸的LNPs,但粒径分布较窄。我们还使用激光扫描共聚焦显微镜评估了微流控装置的混合速率,并估计了控制LNP大小的临界乙醇浓度。临界乙醇浓度范围估计为60-80%乙醇。利用混沌混合器结构的微流控装置,在临界浓度下,实现了10纳米尺寸的LNPsZ佳停留时间的调谐。对于30、40和50纳米尺寸的LNPs,在临界浓度下控制LNP大小所需的停留时间分别为10、15-25和50 ms时间尺度。Z后,基于确定的LNP形成行为和临界乙醇浓度,提出了LNP形成机制。微流控装置生产的精确尺寸控制的LNPs有望成为下一代纳米药物的载体,并为癌症治疗带来新的有效方法。
脂质纳米颗粒(LNPs)或脂质体是纳米药物Z广泛使用的药物载体。LNPs允许两种靶向模式:通过增强渗透性和保留(EPR)效应的被动靶向,以及使用配体表面修饰的主动靶向。此外,LNPs能够封装多种材料,如低分子化合物、金纳米颗粒、多肽、DNA和RNA。这些特点使基于LNP的纳米药物设计具有高度的灵活性,并且LNPs已被报道取得了良好的治疗效果。纳米药物的大小也被认为是影响治疗效果的重要因素,因为许多大尺寸的纳米药物被pizang的网状结构捕获和过滤。另一方面,小于10 nm的纳米药物被淋巴系统清除。适当大小的纳米药物可以有效地在靶器官中积累,产生高治疗效果。
近年来,纳米药物在肿瘤组织中的穿透效率的尺寸依赖性引起了人们对下一代纳米药物开发的关注。在胶束纳米颗粒中,30 nm大小的胶束比70 nm大小的胶束具有更高的穿透效率。我们还报道了LNP大小对动物实验中进入肿瘤组织的穿透效率的影响。我们向ICR小鼠静脉注射40和70 nm大小的LNP,并评估了siRNA的肝内分布。虽然两种大小的LNP都表现出基因沉默活性,但40 nm大小的LNP能够更有效地将siRNA递送到肝细胞。因此,精确控制颗粒大小是下一代纳米药物开发的理想选择,这种尺寸受控的纳米药物有望实现颗粒大小依赖的药物递送系统。然而,通过传统的LNP制备方法,很难实现LNP的精确尺寸控制,例如,在5-10 nm间隔内调整LNP的尺寸。
基于微流体的技术不仅有望成为LNP合成的优秀方法,而且有望成为包括外泌体在内的细胞外囊泡分离的优秀方法。通过将含有脂质和水溶液的有机溶液注入微流体装置,很容易产生LNP。通常,LNP大小由溶液的流速和流速比(FRR:水溶液流速与脂溶液流速之比)控制,快速混合也是控制LNP大小和生产小尺寸LNP的重要因素。为了提高混合效率,混沌混合器结构已被应用于微流体装置,并通过应用极高流速条件的微流体形成了20 nm大小的LNP。然而,由于流体动力学的原因,混沌混合器在大流速条件下的混合性能下降。因此,我们先前研究了混沌混合器对LNP大小及其大小分布的影响。我们发现,对于控制LNP大小和生产小尺寸LNPs,完全混合盐水和脂质/乙醇溶液是没有必要的。此外,我们提出了微流控装置中LNP的形成机制和临界浓度的概念来控制LNP大小。简而言之,LNPs在微流控装置中是由以下过程形成的:脂质分子的聚集,中间碟状结构的形成,这些中间碟状结构的融合,以及中间碟状结构的转化来包围LNPs。中间碟状结构可以在临界浓度下形成并保持稳定,中间碟状结构的寿命决定了LNP的大小。尽管临界浓度对于LNPs的精确尺寸调节是必不可少的,但临界浓度的范围还没有得到很好的理解。了解LNP的形成机制和临界浓度可以让我们利用微流控技术开发高性能的LNPs生产系统,从而开发下一代基于LNPs的纳米药物。
本研究探讨了脂质浓度和微流控器件的混合性能对LNP形成行为的影响。我们制作了三种微流控器件:具有不同深度(11 μm或31 μm)的混沌微混合器结构的微流控器件和没有混沌微混合器的微流控器件。通过改变流速条件,利用微流控器件测量了LNP大小和混合速率。通过形成的LNP大小与乙醇稀释率的关系,讨论了LNP形成机制和临界浓度。
LNPs的合成
POPC以5、10或20 mg/mL的浓度溶解于乙醇中。盐水由154 mM的氯化钠溶解于超纯水中制备。图1显示了实验装置和微通道结构设计的示意图。我们使用了三种类型的微流控设备:具有不同深度的微流控设备,11 μm(CM_11设备)或31 μm(CM_31设备),其混沌微混合器结构和无微混合器的微流控设备(NM设备)。微通道的总长度为110 mm,CM_11和CM_31设备配备了69个基本混合器结构。微混合器的宽度和间距为50 μm。单独的注射器装满脂质溶液和盐水,注射器连接到微流控器件。我们使用注射泵将溶液送入微流控器件。LNPs通过在微流控器件中混合溶液而连续形成。LNP溶液被收集在PEEK毛细管出口处的微管中。收集的LNP溶液在粒径测量前存放在冰箱中。使用Zetasizer Nano ZS ZEN3600仪器(Malvern Instruments, Worcestershire, UK)的通过动态光散射(DLS)测量LNP的粒径。
首先,我们关注脂质浓度对LNP大小的影响。实验采用CM-31装置。图2(a)显示了流速为100 μL/min,流速比(FRR:水溶液流速与脂溶液流速之比)为3和9时的LNP大小分布。LNP大小随着脂质浓度的增加而增加。无论FRR如何,5 mg/mL POPC/乙醇溶液产生的LNPs尺寸Z小。然后,我们改变流速为500 μL/min,因为流速条件会影响LNP大小。图2(b)显示了流速为500 μL/min,FRR为3和9时的LNP大小分布。我们观察到100 μL/min和500 μL/min之间LNP形成行为相似。低脂质浓度或高FRR条件下能够形成小尺寸的LNPs。我们在图3中总结了不同FRR下脂质浓度对LNP大小的影响。当我们使用5 mg/mL POPC/乙醇作为脂溶液时,100 μL/min形成的LNPs几乎与500 μL/min形成的LNPs大小相同。另一方面,10和20 mg/mL脂质溶液在100 μL/min流速下形成的LNPs比500 μL/min流速下形成的LNPs稍大。通过改变流速,LNP大小的差异约为5 nm和10 nm,分别为100 μL/min和500 μL/min。我们还计算了粒径多分散性指数(PDI),从粒径分布来评估均匀性。如S1图所示,PDI值主要小于0.1。 这些结果表明,脂质浓度是控制LNPs大小的重要因素之一。我们在高FRR和流速条件下能够产生30 nm大小的LNPs,尽管与70 nm LNPs相比沉默效率略有降低,但仍能有效地穿透肿瘤组织。在本研究中,我们使用DLS测量LNPs的大小,因为DLS是目前Z广泛使用的LNP大小评估方法。为了观察实际的LNP大小,我们还尝试用TEM测量阴性染色的LNPs。TEM分析中观察到的LNPs大多为20-30 nm,尽管一些LNP形状由于真空条件下干燥而变形(数据未显示)。因此,通过控制流动条件和脂质浓度,可以精确地实现25 nm到80 nm的LNP尺寸调节。
由于脂质是两亲分子,不能溶解于水溶液中,因此通过混合水溶液和脂溶液,脂质分子逐渐自组装。自组装的中间碟状结构称为双层磷脂碎片(BPFs),它们在热力学上是半稳定的。BPFs生长并Z终转化为包围LNPs。我们发现,通过水溶液的快速稀释可以形成小尺寸的LNPs。在这里,由于乙醇的存在,POPC分子可以溶解。然而,脂溶液和水溶液的混合诱导了乙醇的水合,增加了溶液的极性。当我们使用高浓度的脂溶液时,BPFs经常在盐水-乙醇界面形成。BPFs融合并生长到一个限制尺寸,在所述条件下假定为半稳定。由于BPFs的融合,大量BPFs使生长更大尺寸的LNPs成为可能。因此,高脂溶液浓度下产生的LNP尺寸比低脂溶液浓度下产生的LNP尺寸大。因此,我们假设乙醇的稀释率影响LNP的尺寸。
我们制作了三种类型的微流控设备,CM11,CM31和NM器件,并使用它们来阐明混合或乙醇稀释率对LNP大小的影响。流速和FRR也被改变以确认稀释率对LNP大小的影响。图4(a)显示了流速为50 μL/min和FRR为3和9时的LNP大小分布。LNP大小被微混合器结构显著改变。无论FRR条件如何,CM31器件能够产生直径小于100 nm的适当大小的LNP,这对于药物输送是有效的。相反,CM11器件在FRR为3时产生了直径为100 nm的稍大LNP。然而,当我们采用FRR为9进行LNP合成时,LNP大小几乎与CM31器件获得的相同大小。此外,使用NM设备,我们获得了比其他设备更大的LNP大小和更广泛的大小分布。这些结果表明,乙醇的快速稀释对于生产小尺寸LNP至关重要。图4(b)表示了流速为500 μL/min和FRR为3和9时的LNP大小分布。当FRR为3时,CM_11和CM_31器件之间LNP大小直径差为5~10nm,它们可以形成小尺寸的LNP,而NM器件不能形成直径小于50nm的小尺寸LNP。
我们进行了可视化实验来评估每个微流控装置的混合性能。我们测量了脂质溶液和生理盐水在通过第1、5、10、23、46和69个混沌混合器结构后的合并点的荧光图像。头基标记荧光脂质(Rho-PE)和POPC的混合物被用作脂质溶液。荧光图像由图像J分析,混合速率根据Eq (1)计算。图6(a)显示了CM_31装置不同位置的横截面共焦图像。流速为100 μL/min,FRR为3。我们证实,在通过第69个混沌混合器结构后,溶液被完全混合。图6(b)比较了CM_11和CM_31装置在FRR为3时的500 ms的混合速率。整个微通道的混合速率如图S3和S4所示。x轴表示从脂质和生理盐水在微通道入口合并后的停留时间。CM_31装置的混合性能高于CM_11装置。值得注意的是,对于CM_11装置的50和100 μL/min的流速,与CM_31装置相比,混合性能急剧下降,由于稀释速率较慢而形成大尺寸的LNP。如图5所示,对于CM_11装置,LNP的尺寸范围为60到120 nm,表明在FRR为3时对流速有依赖性,而对于CM_31装置则没有依赖性(尺寸:50-60 nm)。在稀释速率较慢的情况下形成大尺寸的LNP。此外,对于CM_31装置,尽管达到20%混合速率所需的时间不同,在50和100 μL/min的流速下形成了60 nm大小的LNP。这些结果表明,在混合速率超过20%的情况下进行快速混合对于产生小尺寸LNP至关重要。
使用微流控装置合成LNP不需要完全混合,因为即使需要较长的混合时间(>400 ms)才能完全混合,50 μL/min流速下也形成了60 nm大小的LNP。从流体力学观点来看,混沌混合器的Z佳流动条件是雷诺数应在1到100之间。因此,与50和100 μL/min条件(混沌混合器结构5的混合率为60%-70%)相比,500 μL/min条件(混沌混合器结构5的混合率为40%)的混合性能略有下降。然而,高流速条件可以在单位时间内快速通过许多混沌混合器结构。因此,高流速条件能够在所有流动条件中产生Z小的LNP。
图6(c)比较了CM_11和CM_31设备在FRR为9时的500 ms的混合速率。与FRR 3时的性能相比,CM_11设备的混合性能得到了改善。在相同流速条件下,CM_11和CM_31设备之间获得的LNP尺寸直径差几乎为5 nm(图5)。在这里,我们重点关注50和100 μL/min条件,以阐明产生小尺寸LNP的临界混合速率或临界乙醇浓度。在这两种流速下,混合速率在通过第1混沌混合器后增加。然而,无论流速如何,经过第5混沌混合器后的CM_11设备的混合速率都高于40%。在通过第5混沌混合器后,混合性能下降,然后在第10混沌混合器时混合速率增加到60%。另一方面,CM_31设备在第5混沌混合器的混合速率分别计算为50和100 μL/min流速的70%和60%。然而,在CM_11设备中,48 nm大小的LNP在50 μL/min时形成,在其他条件下形成40 nm大小的LNP。换句话说,在这些条件下LNP的尺寸几乎是相同的.从这些结果中,我们假设20%到40%的快速混合是产生小尺寸LNP和控制LNP尺寸的关键因素.在FRR为9的情况下,根据图6(c),粗略计算出在每个流速条件下20%到40%的混合速率的斜率为0.4-2%/ms.这表明,在FRR为9的情况下,对于30、40和50 nm大小的LNP,分别在10、15-25和50 ms时间尺度上进行混合,从而形成LNP。
LNP形成过程
微流控装置中LNP形成过程的总结如图7所示。我们重点关注乙醇的稀释速率和基于BPF形成过程的脂质浓度。由于溶液极性的增加,脂质的疏水链自组装。半稳定的BPFs生长,直到它们转化为稳定的闭合囊泡(即LNPs),如图7(a)。 BPFs的生长诱导反应体系中表面能的增加。当BPFs附近的乙醇浓度适中时,BPFs能够生长,直到它们达到热力学稳定的大小。然后,生长的BPFs转化为LNPs,以降低反应体系中的表面能。当BPFs周围的乙醇被快速稀释时,BPFs不能生长足够形成大尺寸的LNPs(图7(b))。
简而言之,完全混合条件下的乙醇浓度分别是25%和10%,FRR分别为3和9。从实验结果和LNP形成过程的假设来看,我们假设BPFs在80%乙醇条件下开始形成(混合速率为20%),并在60%乙醇条件下(混合速率为40%)转化为LNPs。因此,我们认为60%至80%的乙醇浓度对于该实验系统中产生小尺寸LNPs和控制LNP大小至关重要。临界浓度可以根据实验条件而改变,如脂质、溶剂和添加剂的浓度和类型。虽然混合速率或表观乙醇浓度被认为是溶液均匀性的指标值,但LNP大小不仅受设备的混合性能影响,还受脂质浓度和FRR的影响。BPFs和LNPs是在盐水-乙醇界面形成的,乙醇分子的水合和脂质分子的聚集触发了LNP的形成。因此,我们认为完全混合对于控制LNP大小是没有必要的。例如,使用NM装置,在流速为500 μL/min和FRR为9的情况下,可以产生70 nm大小的LNP,只有很小的尺寸偏差。在微通道中,乙醇的浓度梯度在盐水-乙醇界面形成。从流体动力学的角度来看,高流速下混合溶液所需的距离比低流速下长。换句话说,即使FRR可能相同,高流速下微通道中也会形成一个狭窄的浓度梯度。事实上,我们证实了高流速在微流体装置出口的混合速率小于低流速。在这种情况下,乙醇的水合作用主要是在盐水-乙醇界面的分子扩散。狭窄的浓度梯度使形成具有低LNP大小分布的小尺寸LNP成为可能,因为BPFs只在临界乙醇浓度下生长。高FRR条件下也在液-液界面形成狭窄的浓度梯度。此外,微流控装置的微混合器结构可以通过增加液液界面面积来加速溶液的均匀性。与NM装置相比,增加液液界面面积和缩短扩散距离可以使乙醇快速稀释。因此,我们认为乙醇在液液界面上的快速稀释是至关重要的,而不是完全混合。
高FRR条件或脂质浓度也影响LNP大小。在高FRR的情况下,盐水-乙醇界面上的脂质分子数量低于低FRR。因此,高FRR被认为与低脂质浓度条件具有相同的效果,并使用CM31设备产生30-40 nm大小的LNP。另一方面,高脂质浓度产生大尺寸LNP,无论流动条件如何,如图3所示。脂质浓度不影响混合速率或乙醇的稀释速率。因此,在高脂质浓度条件下,BPFs经常在液-液界面形成(图7(c))。这种BPF形成行为类似于晶体成核过程。BPFs通过与单个小尺寸BPFs融合生长,然后弯曲BPFs形成封闭的LNPs。BPFs的生长速率取决于BPFs的浓度和乙醇的稀释速率。在BPFs的高浓度下,很容易融合每个BPF,然后形成大尺寸LNP。通过MD模拟,从BPF到封闭形式的转化率估计需要100-200 ns。然而,BPF的生长过程比转化过程需要更长的时间,包括以下过程:脂质分子的聚集、BPF的形成、BPF的扩散和BPF的融合。因此,我们假设LNP大小由BPF生长过程决定,而使用微流控器件可能实现的快速稀释为精确控制LNP大小提供了一种有前途的方法。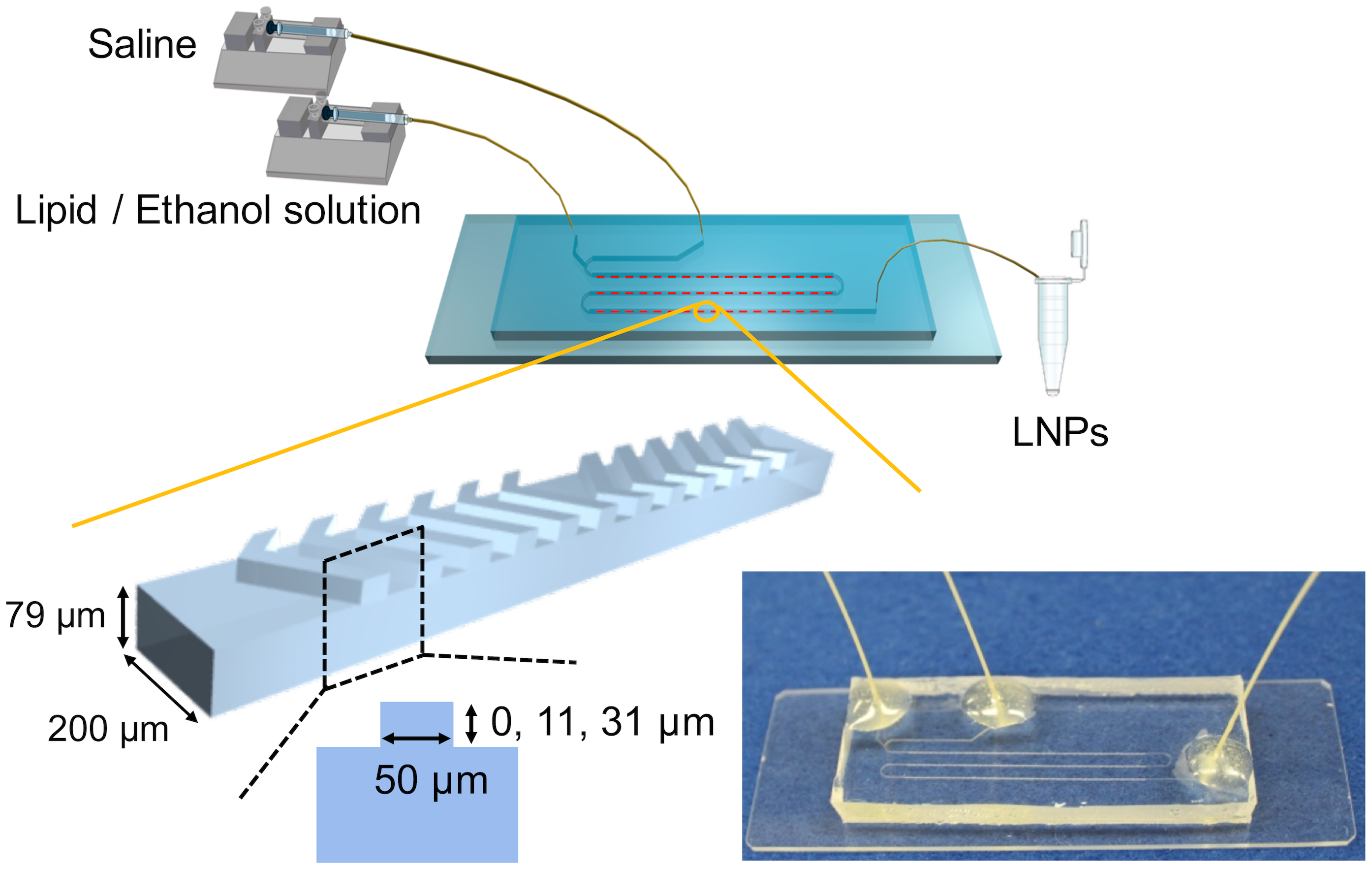
图1,实验装置示意图和照片。
微通道的宽度和深度为200和79 μm。微通道的总长度为110 mm。混沌混合器结构的高度分别为0,11和31 μm,对应于NC器件(没有微混合器),CM_11器件和CM_31器件。放大图像显示混沌混合器结构的一个周期。CM_11和CM_31器件配备了69个循环的混沌混合器结构。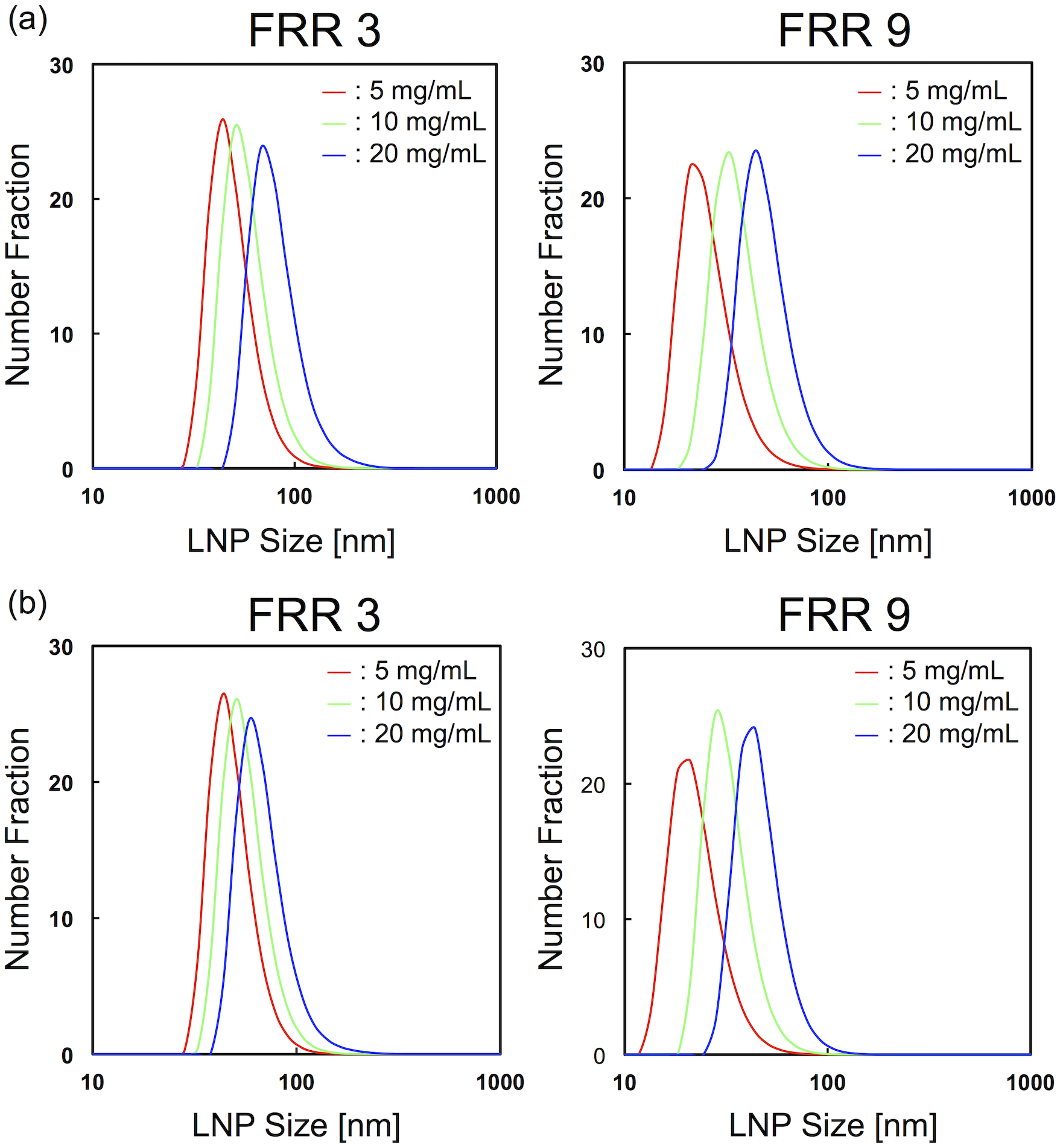
图2,不同脂质浓度条件下,FRR为3和9时LNP的粒径分布。
流速分别为(a)100 μL/min和(b)500 μL/min。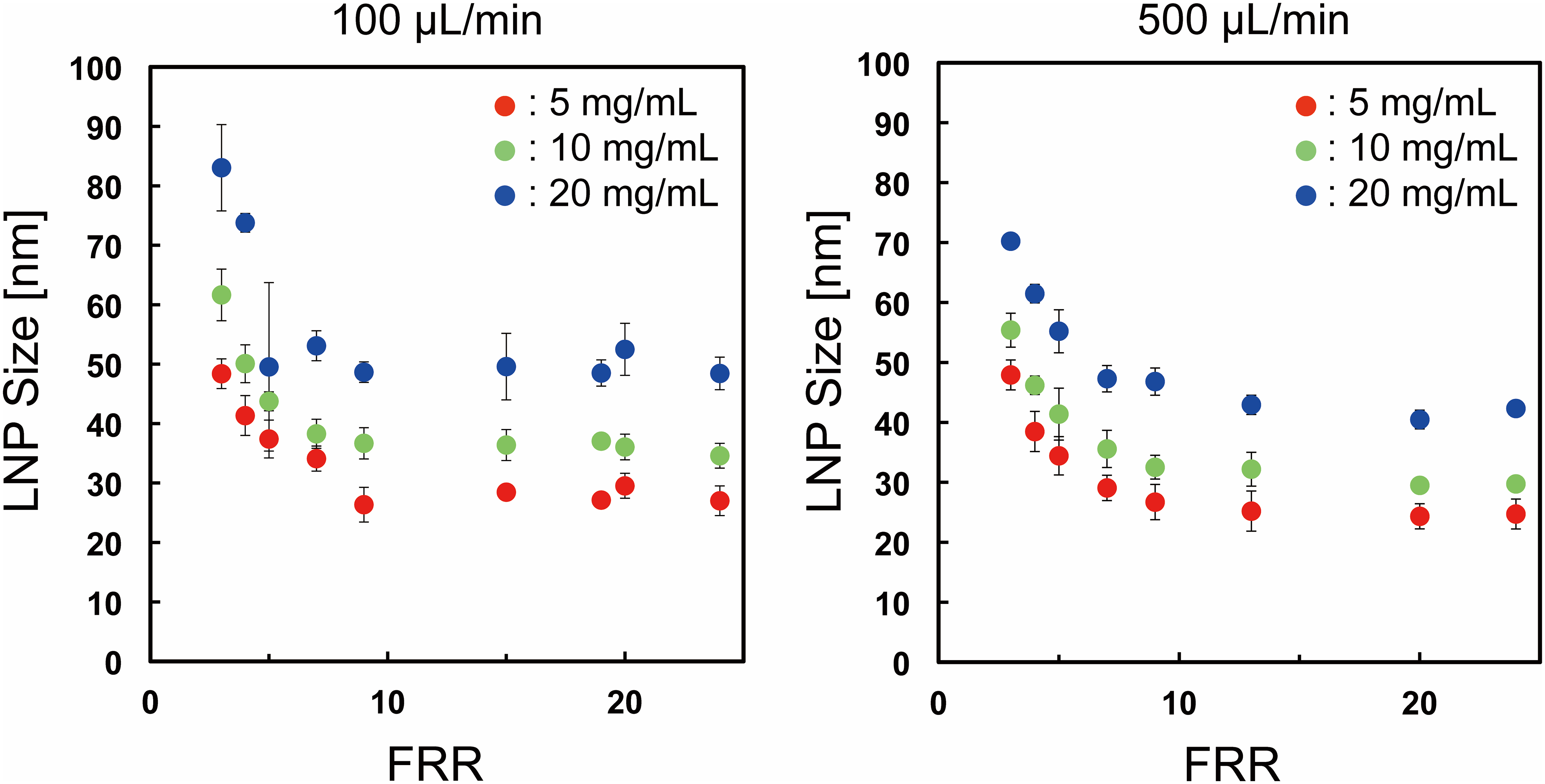
图3,不同流速条件下脂质浓度对LNP尺寸的影响。
误差柱表示每个LNP形成实验至少重复三次计算的标准偏差。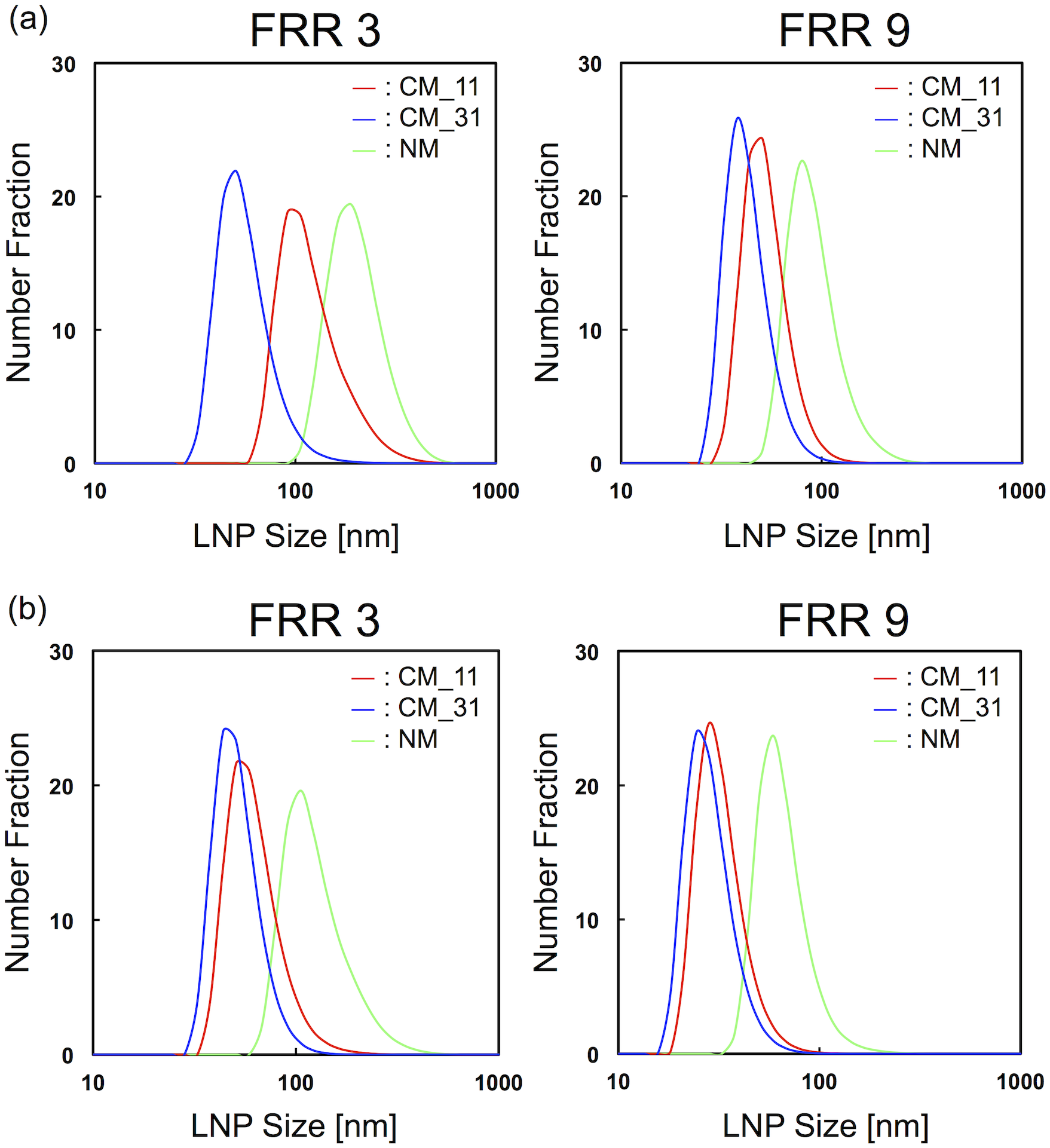
图4,在FRR为3和9的微流控装置中形成的LNPs的尺寸分布。
流速分别为(a)50 μL/min和(b)500 μL/min。
图5,不同流动条件下混合器结构对LNP尺寸的影响。
误差柱表示每个LNP形成实验至少重复三次计算的标准偏差。
图6,微流控器件混合性能的评估。
(a) CM_31器件不同位置的横截面共焦图像。图像的测量位置是在通过混频器结构之前(0个循环),以及通过第5个和第69个混频器结构之后。流速为100μL/min,FRR为3。(b-c)在(b)FRR为3和(c)FRR为9时,CM_11和CM_31器件之间500ms的混合速率的比较。图表表示通过第1个,第5个,第10个,第23个,第46个和第69个混频器结构后的混合速率。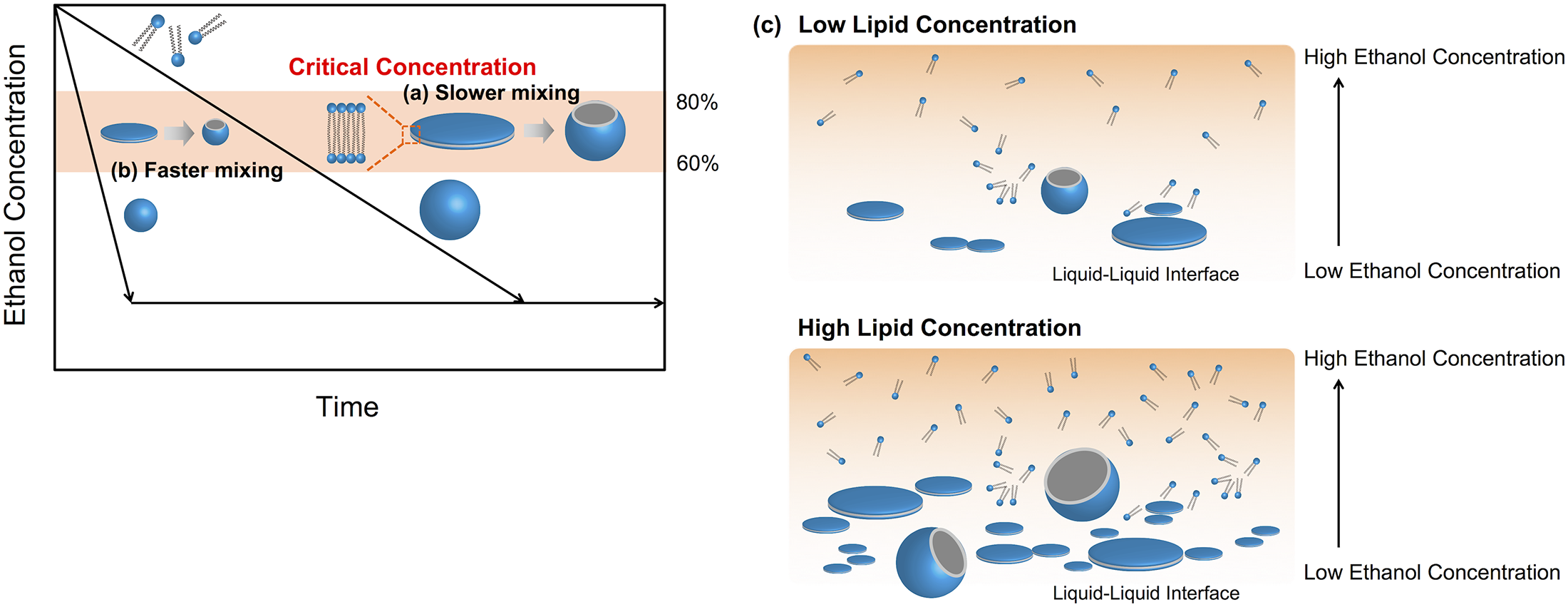
图7,微流控装置中LNP形成过程的总结。
微流控装置中LNP形成过程在(a)慢速混合和(b)快速混合时。(c)盐水-乙醇界面LNP形成的示意图。
参考文献:
Maeki M, Fujishima Y, Ishida A, et al. PLoS ONE, 2017 12(11): e0187962.
-
- T型结构液滴产生芯片(topconnect)
- 品牌:荷兰Micronit微流控芯片
- 型号:T-SHAPED

-
- 液滴发生器线性芯片 – 鲁尔接口
- 品牌:达尔文微流控
- 型号:

-
- 乳液破乳剂/液滴破碎剂Fluo-Beaker
- 品牌:法国Emulseo
- 型号:Fluo-Breaker

-
- Emulseo Fluo-ST1和ST2表面疏水处理试剂/疏水溶液
- 品牌:法国Emulseo
- 型号:Fluo-ST

-
- 氟油7500(HFE7500调配)
- 品牌:法国Emulseo
- 型号:Fluo-Oil 7500

-
- 简易切换阀和阀控制器WIRE V3
- 品牌:法国Elveflow
- 型号:valve and valve controller

-
- 简易切换阀及阀控制器WIRE
- 品牌:法国Elveflow
- 型号:valve and valve controller

-
- 新升级精密压力流量控制器OB1 MK4
- 品牌:法国Elveflow
- 型号:OB1 MK4


