用电导法测定乙酸乙酯皂化反应速率常数是物理化学动力学部分的一个基础实验。
目前,大多数高校都是在乙酸乙酯和氢氧化钠初始浓度相等的条件下进行皂化反应实验。但是乙酸乙酯易挥发,其水溶液会水解;氢氧化钠又必须是新配制的,要满足这一条件很难做到。同时,实验要求温度恒定,并且要求反应物混合时间短,这种情况较难找到一种适合的反应器。
针对本实验的问题采取了一些改进措施,主要有两方面:(1)改进了反应器;(2)改进了反应物的混合方式。改进之后,学生实验效果良好。
1、实验仪器和试剂
仪器:皂化反应实验装置,电子天平(规格1200g/0.1g),电子天平(规格110g/0.1mg),纯水机(UPT-I-20T),单通道移液器(规格10-100μL),磁力搅拌器(78HW-1),计时器,恒温反应器(自制),碱式滴定管(50.00mL)。
试剂:氢氧化钠(分析纯),乙酸乙酯(分析纯),邻苯二甲酸氢钾(分析纯),纯水,酚酞指示剂。
2、实验原理
详细实验原理可参见教材,本实验采用下列速率方程计算速率常数:
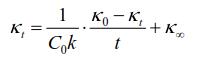
通过实验测定起始溶液的电导率κ0和不同时间t溶液的电导率κt,以κt对(κ0-κt)/t作图,得一直线,从直线的斜率可求出反应速率数k值。使用Origin软件处理实验数据,可得到直线斜率和相关系数R。
3、实验步骤
实验操作步骤与教材基本相同,下面列出改进后的操作。
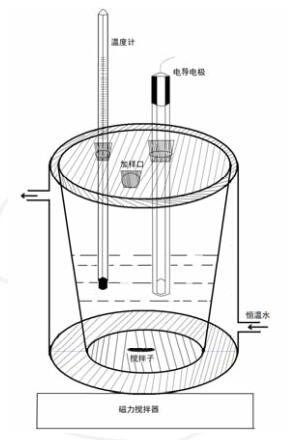
①实验装置图
改进后的实验装置如下图所示:反应器内部采用高型烧杯形状,外部是恒温夹套;为了使反应器内的溶液有足够的高度和杯口有足够的宽度,方便磁子搅拌并放置电导电极与温度计,反应器内部设计为梯形。杯口用硅胶(或橡胶)塞密封,开3个圆孔,分别为电极插口、温度计插口和加样口。
②溶液配制
用精度0.1g天平称量氢氧化钠固体,用新鲜纯水配制成一定体积的溶液,浓度约为0.01mol/L。用精度0.1mg天平准确称量邻苯二甲酸氢钾,对氢氧化钠溶液进行浓度标定。得到准确的浓度C0后,用下式计算等摩尔量的分析纯乙酸乙酯体积V(μL):
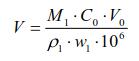
式中,C0、V0分别为NaOH溶液的浓度和体积;
M1、ρ1、w1分别为分析纯乙酸乙酯的分子量、密度、质量分数。
③κ0及κt的测定
(1)用乳胶管连接恒温水浴,开启恒温水浴,设定温度。
(2)用大肚移液管准确量取50.00mL氢氧化钠溶液置于反应器中,磁力搅拌器缓慢搅拌,温度恒定后,测定电导率κ0。
(3)计算出所需乙酸乙酯的用量,用量程为10~100μL的移液器量取。
(4)将磁力搅拌器速度开到Z大,取下橡胶塞加入乙酸乙酯,同时计时,然后塞上橡胶塞。
(5)持续快速搅拌约1min后,将搅拌速度减慢,保持慢速均匀搅拌。然后依次记录2,4,6,8,10,12,15,20,15,20,25,30,35,40min时刻的电导率κt。
(6)清洗实验用品,用Origin软件处理实验数据。
1、改进措施
通常实验教材的方案需要配制0.02mol/L、0.01mol/L的氢氧化钠溶液和0.02mol/L的乙酸乙酯溶液,但是乙酸乙酯微溶于水且其水溶液会水解,水解产物为乙酸(CH3COOH)和乙醇(C2H5OH)。虽然消耗氢氧化钠的量没变,但是乙酸与氢氧化钠的反应速率极快,会造成电导率急剧减小,引起较大的误差。
有教材使用微量注射器量取乙酸乙酯注入装有氢氧化钠溶液的锥形瓶中,手摇混合。有教材采取玻璃泡封装乙酸乙酯置入氢氧化钠溶液中后,压破玻璃泡摇动反应器混合反应物。这种加样方式能够避免乙酸乙酯水解,但是量取工具不够精确或者操作麻烦,并且所采用的反应器不方便恒温。
基于以上原因,改进反应器,可以方便地控制和测量反应温度。使用微量移液器量取分析纯乙酸乙酯加入到0.01mol/L的氢氧化钠溶液,体积一般在0.05~0.10mL。微量移液器具有准确性高和重复性好特点,近年来广泛用于生物、化学实验室,常用来精确量取小容量液体。为了更快地使反应物混合均匀,本实验使用了磁力搅拌器,在加乙酸乙酯前将搅拌速度调到很大,加入乙酸乙酯后继续快速搅拌1.5min。
改进后实验操作的优点在于:(1)不再配制乙酸乙酯水溶液,可以避免乙酸乙酯水解对实验造成不利的影响;(2)只需配制0.01mol/L的氢氧化钠溶液,可以忽略加入乙酸乙酯后的体积变化,因此不必更换溶液而方便测得κ0。(3)采用磁力搅拌器混合反应物,比其他混合方式更方便。
2、学生实验结果
学生实验均获得了良好的实验效果,大部分同学拟合数据的相关系数R≥0.999,速率常数也接近于文献值。
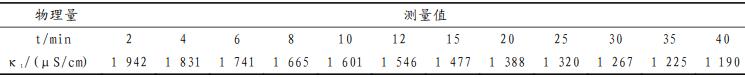
上表是A组同学的实验原始数据,用Origin软件对上表数据进行计算拟合,结果如下图所示。
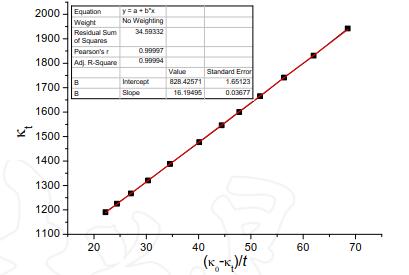
从上图可以得知,A组同学的数据处理结果为:相关系数R=0.99997,斜率为16.19495=1/(C0·k),计算速率常数k=6.6610L·mol-1·min-1,与文献值6.4254L·mol-1·min-1较为接近。
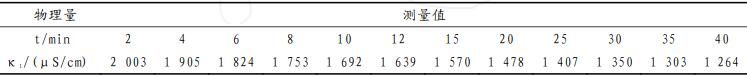
上表是B组同学的实验原始数据,用Origin软件对上表数据进行计算拟合,结果如下图所示。
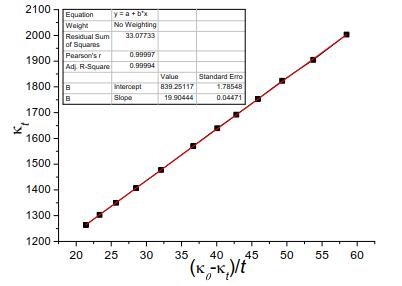
从上图可以得知,B组同学的数据处理结果为:相关系数R=0.99997,斜率为19.90444,计算速率常数k=5.4196L·mol-1·min-1,与文献值5.3039L·mol-1·min-1较为接近。
从以上结果可以看出,本实验改进了反应器和反应物的混合方式后,具有以下优点:(1)可以方便地控制实验温度和混合反应物;(2)学生能够得到较为准确的速率常数和较好的拟合相关系数。