动态光散射 (DLS) 正在成为制药行业中越来越流行的亚微米级药品粒度分析技术。本技术说明试图为使用此技术进行方法开发和验证放行测试的客户提供指导。
1、方法验证
分析方法验证是证明分析程序适合其预期目的的过程5。并非所有验证特征都适用于粒度分析。较早的 FDA 工业指南(非实施)草案文7包括一个专门针对粒度分析的部分。尽管较新的已发布文件取代了较旧的指南草案,但有关粒度分析的较旧部分提供了有关粒度分析与其他技术(如 HPLC)的不同之处的见解。旧文档中的以下声明有助于方法验证工作:
“方法验证通常涉及中间精度和重复性的评估。应保证生成的数据是可重复的,并控制产品的质量。”7
考虑到这一评论,下面提供了解决 DLS 方法验证的建议
● 特异性:N/A,DLS 检测大小变化但对不同化学物质不敏感。
● 线性:N/A,DLS 没有任何线性关系。
● 准确性:N/A,仪器的准确性使用标准粒子进行验证,但缺乏公认的定量裁判方法(SEM/TEM 显微镜)不包括准确性确定。包括样品的 SEM/TEM 图像以支持方法验证可能是更合适的。
● 精密度(重复性、中间精密度和重现性):这是需要重 点关注的地方。通常这些术语的定义在粒度分析领域可能不同于其他技术。以下评论来自粒度分析领域:
重复性:多次测量样品。
重现性:准备样品、测量、丢弃、清洁、重复。建议的方法是制备五份样品,然后对每个样品进行五次分析。
中间精密度:此活动涉及第二位分析员、第二台仪器或两者兼而有之。如果所有测试都在一个地点进行,则由同一系统上的不同操作员在不同日期分析同一批次的样品。如果要在多个地点进行测试,则同一样本(或批次)由不同操作员在不同地点的不同系统上进行分析。
● 范围:N/A,仅在所用系统的工作范围内工作。无需对此进行测试或记录。
● 定量限:N/A,这只是测试粒径。
● 检测限:N/A,方法开发应确保样品在系统检测限内。
一旦一种方法得到验证,该程序就应该用于产品的生命周期。如果需要重复调整,则应重新评估和重新验证该方法。
2、结构示例
两名操作员在两个 Nicomp DLS 系统上分析了一种药物物质(异丙酚乳剂)。该样品已过期,但仍显示符合 USP <729> 的合格结果。仪器设置如下:
Instrument A:
Instrument type | Nicomp 3000 |
Age | 5 years old |
Laser power | 35 mW |
Detector | PMT |
Detector angle | 90° |
Software version | ZPW388 V2.17.0215 |
Instrument B:
Instrument type | Nicomp 3000 |
Age | new |
Laser power | 15 mW |
Detector | PMT |
Detector angle | 90° |
Software version | ZPW388 V2.17.0215 |
3、方法开发
首先分析 92 nm PSL 标准以确保适当的系统性能。测量结果在预期值的 98% 以内。建议在开始此类工作之前进行此验证测试。
接下来进行快速研究以测试浓度(稀释)的影响。参见图 1 中的结果。
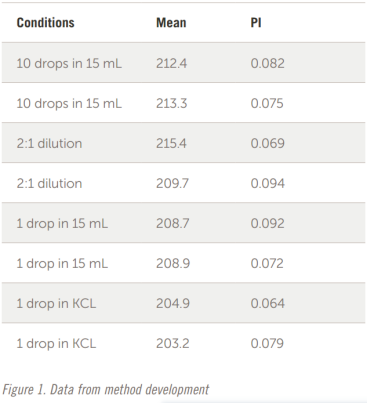
将 10 滴样品加入 15 mL 去离子水中并进行分析。重复相同的制备。然后将这些样品按 2:1 稀释并进行分析。样品看起来太浑浊,结果发生变化,因此将下一滴添加到 15 mL DI 水中。样品出现轻微混浊,这些结果是可以接受的。有时,稀盐溶液是比纯去离子水更好的稀释剂。下一步是将一滴样品加入 10 mL 过滤后的 10 mM KCl 溶液中。这些结果似乎更好,因此 10 mM KCl 溶液用于本研究中的所有其他测量。
在进行稀释研究时,分析时间也从3分钟到10分钟不等。三分钟、五分钟和十分钟分析时间的时间曲线图如图2-4所示。红色=光强粒径平均值,蓝色=体积粒径平均值,蓝色=数量粒径平均值。
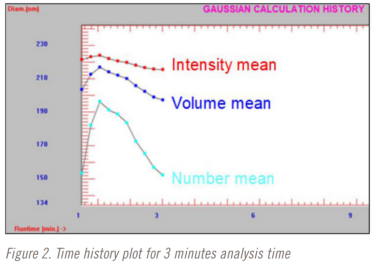
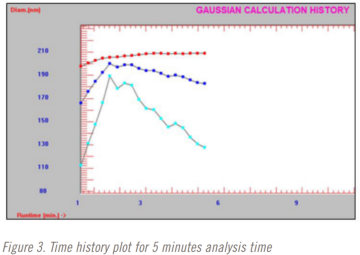
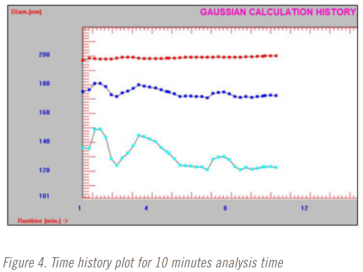
该方法选择了5分钟的分析时间。在五分钟的分析时间完成之前,光强平均粒径结果已经稳定下来。但直到大约9分钟前,体积和数量加权平均结果仍在变化。这是也是在使用DLS时仅选择光强粒径结果的一个原因。这可能是方法开发中测试重复性很好的一个点。在这种情况下,也许下一个测试的分析时间是四分半、五分和五分半钟。在这项研究中没有执行这一步骤,值得指出的是,整个方法开发和验证研究在不到8个小时内完成。更严格的最 终发布测试方法开发和验证方法很可能需要至少几天时间。
4、样品准备
——在干净的瓶子里装满10毫升过滤后的KCl溶液
——用针头注射器取出0.5毫升异丙酚
——在瓶子里注入1滴异丙酚和10毫升KCl溶液
——手旋转直到完全混合(10秒)
——用一次性移液管将400μL样品移入圆形一次性玻璃样品池
——将玻璃样品池放入黑色Holder支架·在Nicomp上打开样品盖
——将样品池和支架插入Nicomp系统,Holder支架背向Nicomp的左侧
——关闭Nicomp上的样品盖
确保仪器设置与如下所示的值匹配:
Temp | 23°C |
Viscosity | 0.933 cP |
Liquid index of refraction | 1.333 |
Intensity setpoint | 300 KHz |
First channel used | 2 |
External fiber angle | 90° |
Scattering angle | 90° |
Print molecular weight | unchecked |
Autoset channel width | checked |
Autoset sensitivity | checked |
Auto nicomp parameter | checked |
Auto baseline adjust | checked |
Cum % set point | 10% |
Autodilution ND position | N/A |
Number of print/save cycles | 5 |
Using run time | 5 minutes |
Using fit error | unchecked |
Clear autocorrelator | unchecked |
Print result | unchecked |
Automatic choice of distribution | unchecked |
Store data on disk | checked |
Overwrite old file | unchecked |
Save data log | checked |
——单击绿色“G”图标开始测量
——打印并记录平均直径、标准偏差、PI 、D10、D50 和 D90
——将结果输入 Excel 电子表格
——计算五项分析的平均值和变异系数
——比较两个数据集
5、结果
样品在 A 和 B 系统上独立制备和分析。每个样品分析五次以检查重复性。这两个系统的示例结果如图 5 和图 6 所示。
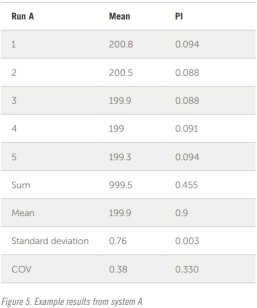

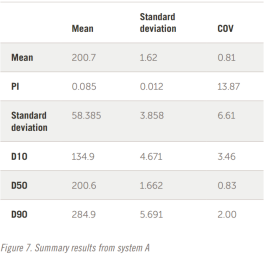
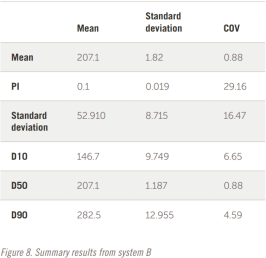
整个结果以表格形式显示在图 7 和图 8 中。五个结果的叠加如图所示。
6、结论
查看综合结果可以得出以下几点观察结果:
——即使是相隔数年生产的两个系统也会生成相似的数据
——两个系统之间存在明显的 3% 偏差
——PI计算可能不是用于定义宽度分布的最 佳值
——如果使用PI,则30%的差值似乎是合适的
——D10、D50、D90 结果显示出更好的重现性,可能更容易为制药行业所接受
纯粹基于该数据集,基于三个测量的该药物产品的规格可能类似于:
——光强平均值 = 200 nm ±20%,COV = 小于 20%
——D10 = 140 nm ±30%,COV = 小于30%
——D90 = 284 nm ±30%,COV = 小于 30% 或
——PI = 0.09 ±30%
上述建议规格仅来自观察到的重现性,可能对药物安全性或有效性没有任何影响。USP <729> 中的实际是否通过标准的要求只是粒径尺寸必须低于 500 nm 并且具有低x2值。质量标准的另一种方法可能是关注影响有效性和/或安全性的粒径大小。本技术说明收集的数据是让您了解 DLS 技术对于简单样品的可重复性/重现性
7、仪器介绍
Nicomp纳米激光粒度仪系列
Nicomp系列纳米激光粒度仪采用动态光散射原理检测分析样品的粒度分布,基于多普勒电泳光散射原理检测ZETA电位。

粒径检测范围0.3nm-10μm,ZETA电位检测范围为+/-500mV
搭载Nicomp多峰算法,可以实时切换成多峰分布观察各部分的粒径。
高分辨率的纳米检测,Nicomp纳米激光粒度仪对于小于10nm的粒子仍然显示较好的分辨率和准确度。

高斯粒径分布图 多峰粒径分布图
参考资料
1 USP <729>, Globule Size Distribution in Lipid Injectable Emulsions,http://www.usp.org/
2 ISO 22412 Particle size analysis — Dynamic light scattering (DLS),https://www.iso.org/home.html
3 USP <429>, Light Diffraction Measurement of Particle Size,http://www.usp.org/
4 Entegris Technical Note, DLS Sample Preparation
5 Analytical Procedures and Methods Validation for Drugs and Biologics, July 2015,https://www.fda.gov/media/87801/download
6 Entegris Technical Note, DLS System Verification
7 Guidance for Industry, Analytical Procedures and Methods
Validation, Draft Guidance, July 2000. No longer available for download at FDA website.
8 Entegris Technical Note, DLS Data Interpretation
 组织透明化方法知多少
组织透明化方法知多少
 ISCO培训--Prep SFC方法开发的新技术
ISCO培训--Prep SFC方法开发的新技术

 评论
评论