
“码”上参与

扫码即可参与游戏
赢得奖品
第 7 期文章
文中有答案!
为了满足中国 NMPA、美国 FDA、欧盟 EMA 等国内和国际法规监管机构的 GMP 法规要求,制药及生物制药企业,药品原料及中间体 QC 实验室,需要对其实验室仪器与软件(包括细胞分析仪器及软件)进行完整的确认(DQIQOQPQ)并进行计算机系统验证(CSV)。
CSV 确保计算机化系统按照用户的预定用途正常运行,并遵循以下法规要求(包括但不限于):
FDA 21 CFR Part 11
FDA 21 CFR Part 210/211
EU GMP Annex 11
PIC/S PI-011
NMPA GMP2010 版,2015 年附录 < 计算机化系统>
NMPA,2020 年<药品记录与数据管理要求>
其他原因
面对国内外客户和 GMP 审计 , 软件升级
CSV 中关键法规风险控制点
计算机化系统验证过程中,需要充分识别系统潜在的风险(如业务流程风险、数据可靠性风险等),并采取合适的措施,如系统正确配置、验证测试和必要的 SOPs 程序控制等,将这些法规风险降至最 低。
系统潜在的数据可靠性风险主要包括
(但不限于):
电子记录安全性
系统登录与密码安全
角色与权限分级
审计追踪
数据备份与还原
灾难恢复
电子签名
数据完整性(ALCOA)
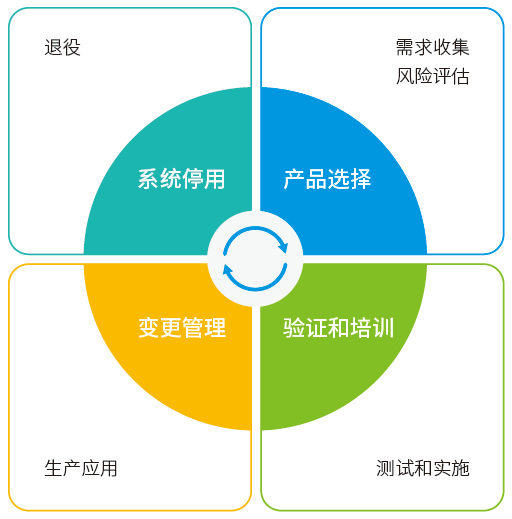
CSV 生命周期
计算机化系统验证 CSV 是一个生命周期,贯穿产品/ 供应商选择、系统部署与验证测试、投入生产使用,以及系统退役的整个阶段。
安捷伦计算机化系统验证,参考国际制药工程协会 ISPE 最 新第二版 GAMP5 基于风险的 V 模型验证方法学,并结合客户软件特点和实际工作流程以及客户内部质量体系要求,提供定制化的法规咨询服务。
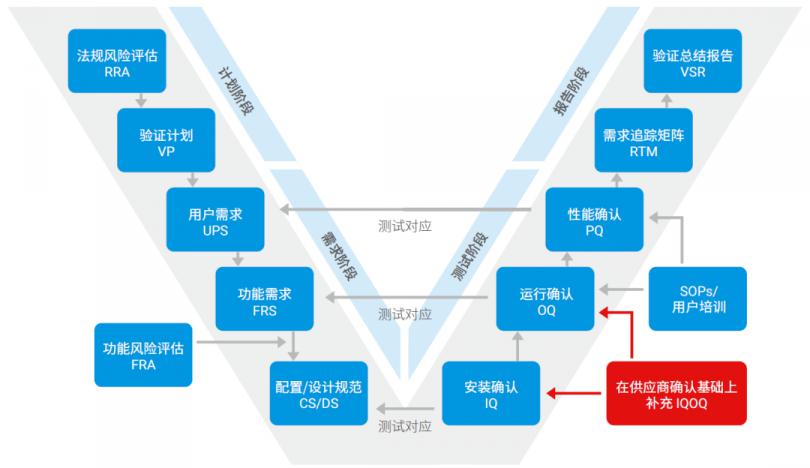
涵盖从安装到 PQ 测试以及最 终系统发布的整个流程
安捷伦法规专家可提供定制化服务:审计、咨询、文档编写、测试执行和培训服务
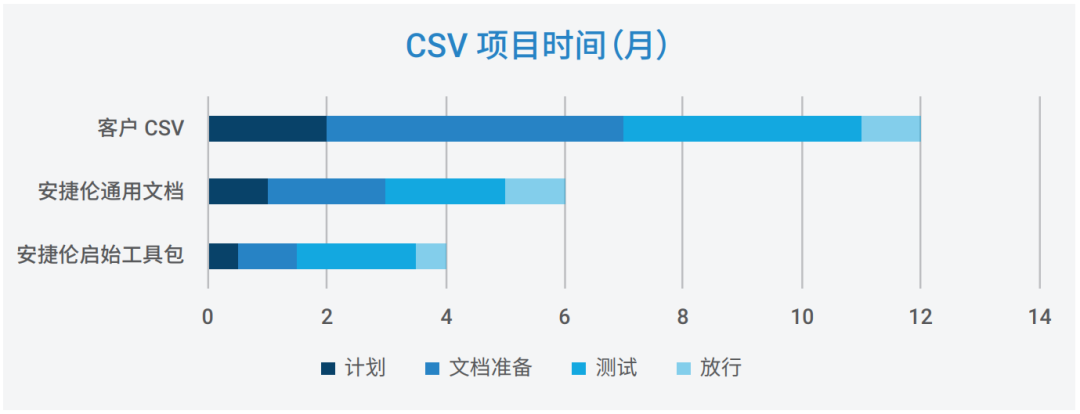
安捷伦验证启始工具包 - 节省最 多 50% 交付时间

 评论
评论