
前言
药物靶点识别在药物发现价值链中起到关键作用。药物开发的关键步骤是识别潜在候选药物的直接靶点并区分任何继发或脱靶效应。
药物靶点识别的方法之一是表型筛选,涉及向细胞(或较小的模型生物)中添加化合物并测量对目标表型或细胞活性的影响1。对于对表型或细胞功能具有所期望的影响的化合物,必须识别活性化合物直接扰乱的基因或基因产物(即,靶点)。因此,药物开发的关键步骤是识别活性化合物的直接靶点以及该化合物可能影响进一步开发的任何继发或脱靶效应。
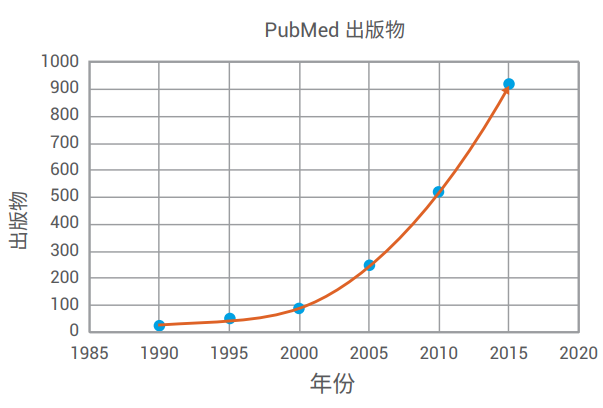
图 1. 按年份绘制的 PubMed 中包括关键词“线粒体”、“药物”和“靶点”的出版物的数量
近年来,已经确定线粒体和细胞代谢过程除具有众所周知的底物氧化和 ATP 生成作用以外,还是细胞分化、细胞增殖、免疫细胞应答、缺氧感受和细胞凋亡的核心2-4。实际上,线粒体和代谢功能障碍越来越多地与众多病理联系在一起,其中包括癌症、免疫细胞和系统疾病、神经退化、心脏病、肥胖和糖尿病以及衰老过程5-7。于是,人们对线粒体和代谢药物靶点的关注大幅增加(图 1)。因此,相应地需要对代谢通路功能进行高灵敏度直接测量,以阐明潜在候选药物的特异性(及任何可能的非特异性)靶点。
安捷伦 Seahorse XF Pro 分析仪以多孔板形式直接测量活细胞中的线粒体呼吸和细胞代谢。因此,该系统是用于检测以线粒体和其他代谢通路(如糖酵解)为靶标的药物的功能效应的理想选择。本应用简报提供了可用于代谢靶点识别研究的Seahorse XF 应用和工作流程的总体概述。
未来,本系列应用简报将探讨如何使用这些分析来阐明药物化合物的特异性和非特异性靶点的有趣案例。
用于线粒体和代谢药物靶点识别的 Seahorse XF 工作流程
本工作流程分为一系列分析,旨在解答以下主要问题:
1. 化合物是否影响线粒体或代谢功能?
2. 化合物的特异性靶点是什么?
3. 是否存在任何非特异性或脱靶效应?
对于在表型筛选中表现为有效的化合物(例如,药物 X),执行安捷伦 Seahorse XF 细胞线粒体压力测试 (MST) 以确定化合物是否影响线粒体功能8, 9。该分析通过测定耗氧率(图 2,左图),对线粒体呼吸的几个关键参数进行了检测。其中发生变化的参数(以及变化幅度)提供了有关化合物是否改变线粒体功能的信息10, 11。该分析的结果还可以确定后续最适合采用哪种类型的 XF 分析设计来采集更具体的信息(包括药物靶点识别)。例如对于药物 X,该工作流程将应用于众所周知的线粒体丙酮酸载体抑 制剂 UK509910。
图 2(右图)显示了在缺乏和存在 UK5099 时的 MST 结果。数据表明,UK5099 确实影响线粒体功能,表现在基础呼吸速率和最 大呼吸速率均有所下降。
药物 X 是否影响线粒体功能?
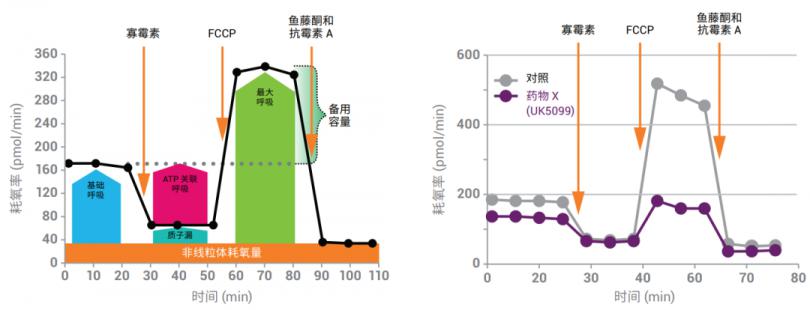
图 2. 左图:安捷伦 Seahorse XF 细胞线粒体压力测试分析设计和输出参数;右图:用 UK5099 对细胞进行预处理后的 MST
接下来,必须考虑代谢的哪些部分可能会驱动这种变化。UK5099 的 MST 图谱表明,在底物氧化和/或电子传递链/氧化磷酸化通路中发生了功能障碍11。这些通路包括底物转运和速率控制蛋白质和酶的活性,包括谷氨酰胺酶、CPT1a、丙酮酸脱氢酶 (PDH)、TCA 循环酶、电子传递和氧化磷酸化机制。
为确定 UK5099 的效果,使用安捷伦 Seahorse XF 细胞膜通透剂 (PMP)。细胞膜透化使得提供的底物可直接进入线粒体中,而无须将线粒体与细胞物理分离10, 12, 13。由于不同的可氧化底物参与不同的代谢通路,因此提供了特定底物的透性化细胞的呼吸速率可用于识别靶点,这些靶点在受到调节后引起可在完整细胞中观察到的线粒体呼吸变化。图 3 简单概述了丙酮酸、谷氨酸和琥珀酸的底物依赖性通路,更多信息参见参考文献10 的图 S3。
因此,工作流程中的下一步 XF 分析是在存在和缺乏候选药物UK5099 的情况下将这三种底物分别提供给透性化细胞。如图 4 所示,UK5099 仅在丙酮酸作为底物时阻止呼吸;向各种类型的透性化细胞(HskMM、NRVM 和原代皮层神经元)提供谷氨酸或琥珀酸时无效。总而言之,这些结果表明:呼吸复合物 I 和复合物 II 都不是 UK5099 的靶点,并且 UK5099 对呼吸的抑 制必定位于复合物 I 和 TCA 循环的上游,因为谷氨酸(复合物 I 底物)或琥珀酸(TCA/复合物 II 底物)氧化都不受影响。此外,这些结果还表明丙酮酸脱氢酶 (PDH) 或线粒体丙酮酸载体 (MPC) 可能是 UK5099 的靶点。然后可以进一步分析透性化细胞和替代底物以区分 PDH 和 MPC,如同证明 MPC 是 UK5099 的特异性靶点一样10。
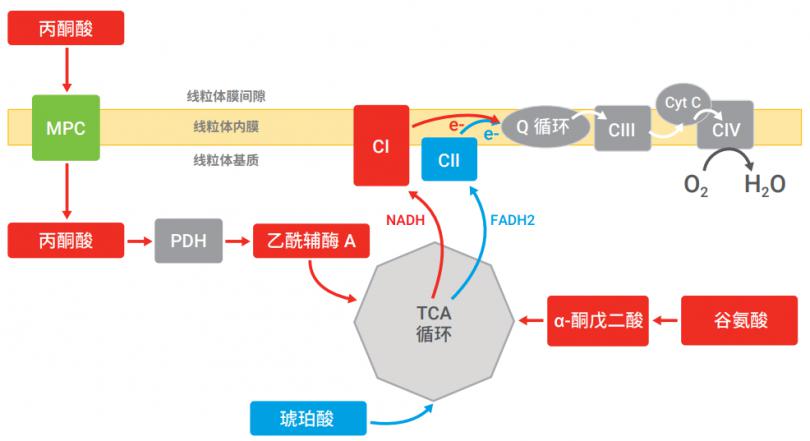
图 3. 丙酮酸、谷氨酸和琥珀酸线粒体氧化通路的简单示意图。复合物 I 和复合物 II 底物和通路分别显示为红色和蓝色。请注意:丙酮酸和谷氨酸都提供 NADH 给 CI,而琥珀酸提供FADH2 给 CII。MPC:线粒体丙酮酸载体;PDH:丙酮酸脱氢酶。为清楚起见,省略了复合物 V 及其他氧化磷酸化组分
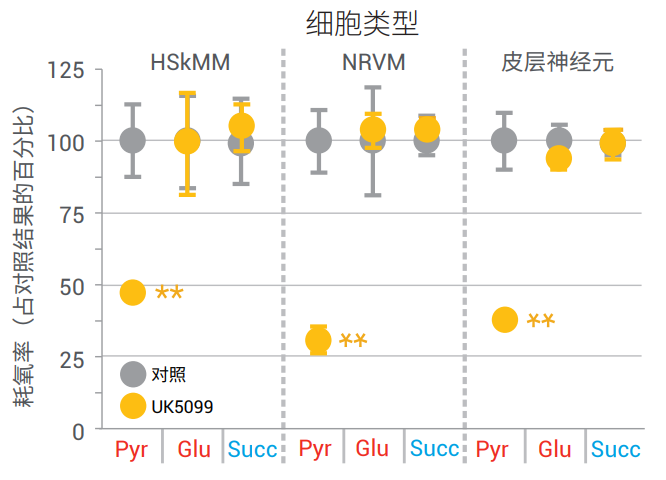
图 4. 提供丙酮酸 (Pyr)/苹果酸、谷氨酸 (Glu)/苹果酸或琥珀酸 (Succ)/鱼藤酮作为唯 一底物的透化性细胞的呼吸;UK5099 仅抑 制丙酮酸驱动的呼吸。HSkMM:人骨骼肌成肌细胞;NRVM:新生大鼠心室肌细胞;皮层神经元:大鼠原代皮层神经元。摘自参考文献 11
总结
我们对代谢作用的理解已经从简单的“管家”演变为许多正常和疾病状态的核心参与者。在活细胞中检测化合物对线粒体功能和代谢表型的影响,提供了一条识别代谢调节靶点的通路。此方法补充了其他方法,例如以信号转导通路和细胞受体为靶标的方法。除 ETC 和氧化磷酸化以外,本文所概述的示例强调了考虑多条线粒体通路(包括底物转运和线粒体酶活性)的重要性。通过将线粒体和代谢功能的直接基于细胞的测量结合到药物靶点识别研究中,可以获得有关化合物的特异性和非特异性效应的重要见解。
参考文献
1. Schenone, M., et al., Target identification and mechanism of action in chemical biology and drug discovery. Nature chemical biology, 2013. 9(4): p. 232–240
2. Dimeloe, S., et al., T-cell metabolism governing activation,proliferation and differentiation; a modular view.Immunology, 2017. 150(1): p. 35–44
3. Ochocki, J.D. and M.C. Simon, Nutrient-sensing pathways and metabolic regulation in stem cells. The Journal of Cell Biology, 2013. 203(1): p. 23–33
4. Smith, R.A., et al., Mitochondrial pharmacology. TrendsPharmacological Sciences, 2012. 33(6): p. 341–52
5. Galluzzi, L., et al., Metabolic targets for cancer therapy.Nature Reviews Drug Discovery, 2013. 12: p. 829
6. Lee, J., Mitochondrial drug targets in neurodegenerative diseases. Bioorg Med Chem Lett, 2016. 26(3): p. 714-720
7. Wang, W., G. Karamanlidis, and R. Tian, Novel targets for mitochondrial medicine.Science Translational Medicine,2016. 8(326): p. 326rv3
8. Wills, L.P., et al., Assessment of ToxCast Phase II for Mitochondrial Liabilities Using a High-Throughput Respirometric Assay. Toxicol Sci, 2015. 146(2): p. 226-34
9. Sanuki, Y., et al., A rapid mitochondrial toxicity assay utilizing rapidly changing cell energy metabolism. The Journal of Toxicological Sciences, 2017. 42(3): p. 349–358
10. Divakaruni, A.S., et al., Thiazolidinediones are acute, specific inhibitors of the mitochondrial pyruvate carrier. Proceedings of the National Academy of Sciences, 2013. 110(14): p.5422–5427
11. Divakaruni, A.S., et al., Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods Enzymol, 2014. 547: p. 309–354
12. Divakaruni, A.S., et al., Etomoxir Inhibits Macrophage Polarization by Disrupting CoA Homeostasis. Cell Metabolism, 2018. 28(3): p. 490–503.e7
13. Divakaruni, A.S., G.W. Rogers, and A.N. Murphy, Measuring Mitochondrial Function in Permeabilized Cells Using the Seahorse XF Analyzer or a Clark-Type Oxygen Electrode.Current protocols in toxicology, 2014.60: p. 25.2.1–25.2.16
 安捷伦Seahorse XF Pro创新引领活细胞代谢分析平台
安捷伦Seahorse XF Pro创新引领活细胞代谢分析平台
 安捷伦Seahorse XF Pro创新引领活细胞代谢分析平台
安捷伦Seahorse XF Pro创新引领活细胞代谢分析平台

 评论
评论