引言
新陈代谢是生物体内进行的化学变化的总称,是生物最基本的生命活动过程。细胞从环境汲取能量、物质,在内部进行各种化学变化,维持自身高度复杂的有序结构,保证生命活动的正常进行。作为细胞的“能量工厂”,线粒体在维持能量稳态方面发挥重要作用,可以调控蛋白质、脂质、溶质和代谢物产物的进出,并保护细胞质免受有害线粒体产物的影响。线粒体通过不断的分裂和融合,维持线粒体形态、分布和数量,维持细胞稳态,该过程被称为线粒体动力学。线粒体自噬是机体清除细胞内功能异常的线粒体的过程,是线粒体质量控制的主要机制。线粒体动力学的病理改变可导致生物能量功能受损和线粒体介导的细胞死亡,并与多种病理机制相关,包括缺血性心肌病,糖尿病,肺动脉高压,帕金森氏病,亨廷顿氏病,骨骼肌萎缩症、阿尔茨海默病等。
线粒体大小和形状取决于它们在细胞内的位置以及不同细胞对能量的需求。当线粒体发生损伤时,它的形态和完整性会发生改变,如线粒体的数量、大小、长度和形状等。线粒体形态、结构和功能的检测对于了解线粒体的稳态以及功能状态有重要意义。
高内涵成像分析系统非常适合进行线粒体表型和结构的研究。共聚焦成像和水镜可以提高成像质量并更好地显示线粒体结构,高内涵的图像分析工具可以帮助科研工作者获得不同表型的数字特征,线粒体表型和结构重排的分析模块可用于线粒体动力学为基础的细胞研究。
结果展示
使用不同浓度的化合物,包括氯喹(抑 制线粒体循环),鱼藤酮(氧化磷酸化抑 制剂)和缬氨霉素(钾离子载体)处理 PC12(人神经母细胞瘤细胞)。将活细胞用线粒体染料 MitoTracker Orange 和 Hoechst 进行染色,利用 ImageXpress Micro Confocal 系统(Molecular Devices)进行成像,使用共聚焦模式和 40X 水镜拍摄活细胞的图像,分辨单个线粒体并检测线粒体形态变化。使用 MetaXpress 高内涵图像采集和分析软件中的 Custom Module Editor(自定义模块编辑器)分析图像,使用“Granularity”模块和“Find Fibers”模块识别圆形颗粒和细长的线粒体(图 1)。
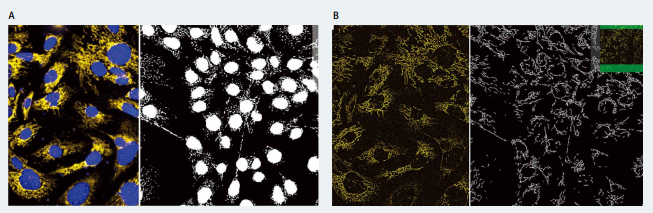
图 1 .线粒体形状的表型分析。
Molecular Devices 高内涵成像分析系统适用于各种细胞模型中化合物的药物开发或毒性评估。不同化合物处理会导致线粒体形态变化,膜电位的损失、以及细胞的程序性死亡等。MetaXpress 软件非常适合进行线粒体形态的测定,可以定义每个对象的数量、面积、强度、长度和形状(表1,2)。使用具有共聚焦模式的 40X 水镜对细胞进行成像,MetaXpress 自定义模块编辑器分析图像(图 2)。这些检测结果可以计算剂量反应和各种化合物的有效浓度,以及用数字来表征线粒体结构动力学(图 3)。
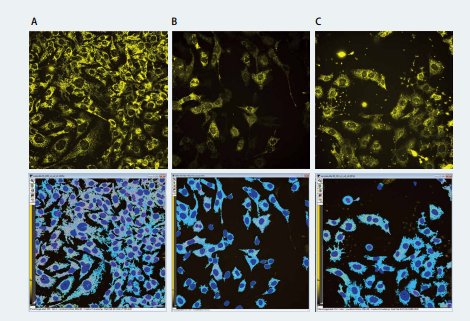
图 2 .化合物对线粒体的作用。使用MitoTracker Orange对线粒体进行染色( 黄色 ),对照组(A)、缬霉素(B)、鱼藤酮(C)。
使用特定浓度的化合物(氯喹,鱼藤酮和缬氨霉素)处理 PC12 细胞,对细胞进行染色和成像。通过图像分析将线粒体结构确定为“纤维”(顶部)或“颗粒”(中部),底部为线粒体染色后荧光强度的变化。EC50的值取决于四个浓度依赖性复本和参数曲线的拟合(图 3)。
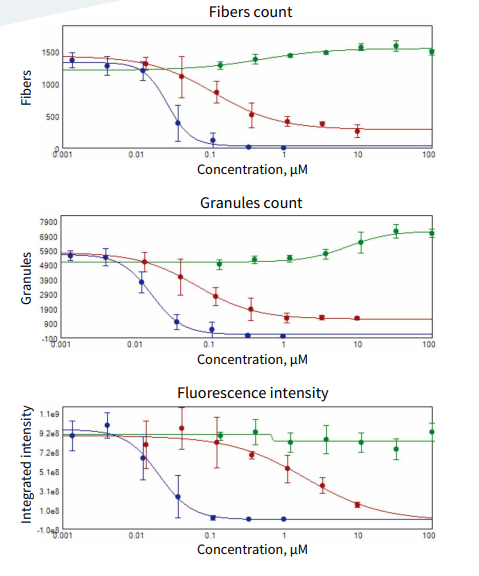
图 3 .使用氯喹(绿色),鱼藤酮(红色)和缬氨霉素(蓝色)处理 PC12 细胞。EC50的值取决于四个浓度依赖性复本和参数曲线的拟合。
在分析过程中,我们比较了水镜和空气镜对图像质量和分析的影响。结果显示,使用水镜可以提高图像质量,并且通常会导致 Z' 值增加( 表 3 )。图 4 显示了使用自定义模块编辑对线粒体表型进行计数和分析,以评估线粒体的健康、代谢、循环、复合效应和疾病状态等。并且,自定义模块编辑可以针对特定的细胞类型或疾病模型进行进一步的调整和修改。
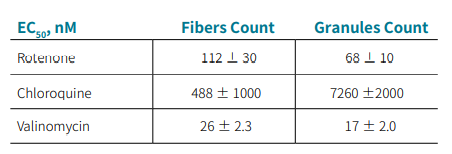
表 1 .用图 3 所示的曲线定量 EC50。

表 2 .不同的对照和化合物处理方法的比较。上面四列数据分别是对照,10 um 的氯喹,300 nm 的鱼藤酮,和 10 nm 的缬氨酸霉素。
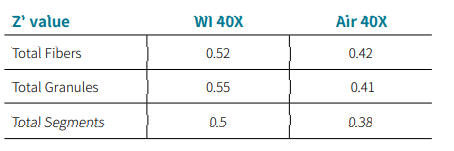
表 3 .与空气镜相比,水镜可以提高图像质量,获得更高的Z’值。
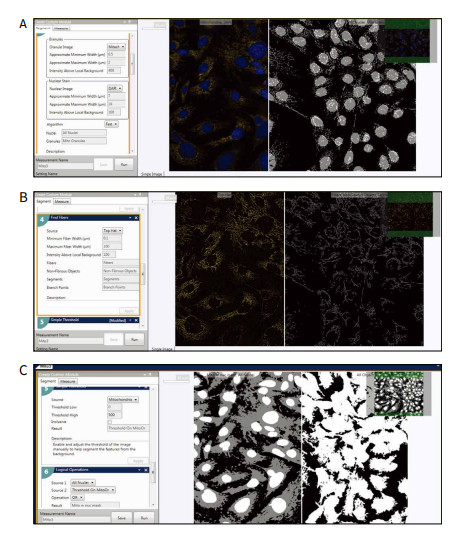
图 4 .自定义模块编辑器(CME)。
总结
Molecular Devices 高内涵成像分析系统适用于各种细胞模型中化合物的药物开发或毒性评估。使用高内涵成像和高级图像分析的线粒体动力学分析方法不仅可以量化线粒体的表型变化,而且这种多参数方法也可用于研究正常和病理结构变化以表征疾病模型或复合效应。
主要特点
获得高质量的图像,更好地显示线粒体形状和结构的变化
以更有效、更精确的方式量化和测量线粒体的表型变化
了解疾病的机制并评估各种细胞模型中的化合物毒性
参考文献:
[1]. Gottlieb RA, Bernstein D. Mitochondrial remodeling: Rearranging, recycling, and reprogramming. Cell Calcium, 2016, 60(2): 88–101.
[2]. Yoon Y, Krueger EW , Oswald BJ , et al. The Mitochondrial Protein hFis1 Regulates Mitochondrial Fission in Mammalian Cells through an Interaction with the Dynamin-Like Protein DLP1. Molecular & Cellular Biology, 2003, 23(15):5409-5420.
[3]. McLelland GL, Soubannier V, Chen CX, et al. Parkin and PINK1 function in a vesicular trafficking pathway regulating mitochondrial quality control. Embo Journal. 2014, 33(4):282-295.
[4]. Twig G, Elorza A, Molina AJ, et al. Fission and selective fusion govern mitochondrial segregation and elimination by autophagy. Embo Journal. 2008, 27:433–446.
[5]. Longo DL , Archer SL . Mitochondrial dynamics--mitochondrial fission and fusion in human diseases. New England Journal of Medicine, 2013, 369(23):2236-2251.
[6]. Qi X, Disatnik MH, Shen N, et al. Aberrant mitochondrial fission in neurons induced by protein kinase C{delta} under oxidative stress conditions in vivo. Molecular biology of the cell. 2011, 22(2):256–265.
[7]. Yu T, Sheu SS, Robotham JL, Yoon Y. Mitochondrial fission mediates high glucose-induced cell death through elevated production of reactive oxygen species. Cardiovascular Research. 2008, 79:341–351.
[8]. Ong SB, Subrayan S, Lim SY, et al. Inhibiting Mitochondrial Fission Protects the Heart Against Ischemia/Reperfusion Injury. Circulation, 121(18), 2012-2022.
[9]. Suen DF, Norris KL, Youle RJ. Mitochondrial dynamics and apoptosis. Genes Dev. 2008, 22:1577-590.
[10]. Konopka AR, Suer MK, Wolff CA, et al. Markers of Human Skeletal Muscle Mitochondrial Biogenesis and Quality Control: Effects of Age and Aerobic Exercise Training. The Journals of Gerontology. 2014, 69(4):371-378.
 应用简报:直接测量细胞代谢以识别线粒体药物靶点
应用简报:直接测量细胞代谢以识别线粒体药物靶点

 评论
评论