小鼠 L929 成纤维细胞的多细胞球体是在µ-Slide 球体灌注中创建的。在从细胞悬浮液中形成球体后,使用 ibidi 泵系统进行灌注。添加 ibidi Pump 可确保球体在长期培养过程中获得最佳营养。
在灌注培养 1 周后,将球体固定并用鬼笔环肽染色以观察 F-肌动蛋白细胞骨架。最后,球体被清除以增强成像深度和分辨率。我们使用EMOVI 方法进行具有成本效益、无害的整体成像,这可以在固定球体上实现基于抗体的多重免疫标记。球体的清除允许分析整个球体成纤维细胞甚至在球体成纤维细胞中心的成纤维细胞的分布和组织,同时保留球体的形态
01材料和试剂
细胞和试剂
•L929成纤维细胞(DSMZ,编号ACC 2)
•Accutase(A1110501,Gibco)
•细胞培养基 RPMI-1640 (Gibco, 21875034)
•胎牛血清 (FCS, Gibco, 10270106)
•细胞内 (IC) 固定缓冲液 (eBioscience, 00-8222-49)
•Dulbecco 磷酸盐缓冲液(PBS、Sigma、D8537)
•正常小鼠血清(Jackson,015-000-120)
•正常驴血清(Jackson,AB_2337258)
•Triton X-100(Alfa Aesar,A16046)
•Flash Phalloidin™ Green 488(鬼笔环肽;500x,Thermo Fisher Scientific,46410)
•4',6-二脒-2-苯基吲哚(DAPI,浓度20μg/mL,西格玛奥德里奇,D9542)
•去离子水 (diH2O)
•异丙醇(Carl Roth,CP41.2)
•肉桂酸乙酯 (ECi) (Sigma, W243000)
02缓冲液和溶液
培养基
•新鲜制备并在 4°C下储存长达一周
•基础培养基 RPMI-1640 (Gibco, 21875034)
•10% FCS ( Gibco,10270106)
封闭和染色缓冲液
•PBS
•1% (v/v)FCS
•1% (v/v) 正常小鼠血清
•1% (v/v) 正常山羊血清
•0.3% (v/v) Triton X-100
染色液
•封闭和染色缓冲液
•1:500 鬼笔环肽(最终浓度 1x)
•1:10 DAPI(最终浓度 2 µg/mL)
30% / 50% / 70% (v/v) 异丙醇稀释液
•混合适当体积的 diH2O 和异丙醇
•使用前预冷至 4 °C
03 设备
•ibidi 泵系统 (ibidi, 10902)
•具有生物惰性表面钝化的 ibidi µ-Slide 球体灌注(ibidi,80350)
•用于 µ-Slide 的 ibidi 串行连接器(ibidi,10830)
•ibidi 灌注套装蓝色 (ibidi, 10961)
•层流罩
•培养箱,37°C 和 5% CO2
•血细胞计数器(康宁)
•移液器(康宁)
•倒置共聚焦显微镜(Leica TCS SP8)
•徕卡应用套件 X
•LIGHTNING(反卷积软件)
•Imaris v9.5
04 操作程序
第一部分:µ-Slide球体灌注中的球体形成和培养
请在使用 µ-Slide Spheroid Perfusion 之前阅读指示。所有步骤均需在无菌条件下执行。
开始实验之前,在标准细胞培养瓶(例如 T75)中制备 L929 成纤维细胞,细胞粘附在底部。细胞在实验当天应该是健康的并且最佳亚汇合。
重要提示:在 37°C 和 5% CO2的培养箱内过夜平衡所有必需的材料,例如载玻片、培养基和管道(灌注套件)。平衡对于防止气泡随着时间的推移而出现至关重要。

1. 将60 µl 无细胞培养基注入 µ-Slide Spheroid Perfusion 的每个通道(根据说明用提供的盖玻片封闭)
2. 在培养箱中 37°C 孵育 2 小时。孵育期间始终关闭盖子。
3. 用 Accutase 处理培养的 L929 细胞 1-2 分钟以使其脱离。
4. 收集细胞悬液,离心,在培养基中稀释;量取决于所需的细胞浓度。
5. 对细胞计数并调整至终浓度为 5 x 105cells/ml。
6. 用无细胞培养基冲洗 µ-Slide 球体灌注的通道,以去除潜在的气泡。
7. 将 45 µl 细胞悬液直接移入每个通道。
8. 在 37°C 下孵育 1 小时,使细胞在壁孔中沉淀。
9. 用60 µl 无细胞培养基填充 µ-Slide Spheroid Perfusion 的储液库。
10. 在 37°C 下孵育过夜以形成球体。
11. 检查通道是否有气泡。如果通道中存在任何气泡,请用无细胞培养基小心冲洗通道。
12. 使用ibidi 串行连接器连接 µ-Slide Spheroid Perfusion 的 3 个通道
13. 根据ibidi 泵系统、流体单元和灌注装置指示.
14. 将µ-Slide 球体灌注连接到 ibidi 泵系统并开始流动。使用尽可能低的流速(5 mBar 气压导致流速为 0.74 ml/min)。进行实验,直到球体具有所需的成熟状态,在这种条件下培养 7 天后。
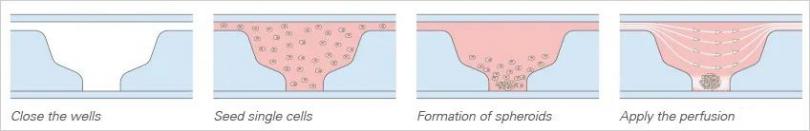
图1:L929 成纤维细胞在孔中形成球体并在流动条件下培养
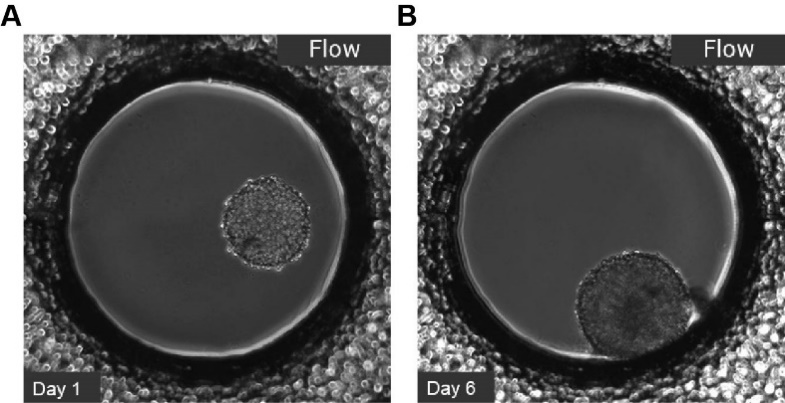
图 2:L929 成纤维细胞在µ-Slide 球体灌注中显示球体形成。第1 天的示例
(A)第 6 天 (B),使用 ibidi 泵系统灌注,0.74 毫升/分钟。相差显微镜,10 倍物镜,井径 800 µm。
第二部分:L929 球体的染色和清除
染色直接在 µ-Slide Spheroid Perfusion 中进行。在开始染色之前,请阅读指示并遵循载玻片中关于一般移液和更换溶液的建议。
1. 当 L929 球体培养达到所需的成熟状态(此处为 7 天后)时,小心地断开 µ-Slide球体灌注与 ibidi 泵系统的连接。
2. 在 RT 处用冷 IC 固定缓冲液固定球体 10 分钟。
3. 在 RT 中将球体封闭和染色缓冲液中孵育 1 小时。
4. 在 37°C 下用染色溶液孵育球体过夜。从这一点开始,保持载玻片避光。图 3A 显示了清除前的球体成像。
5. 第二天,用 Blocking and Staining Buffer 清洗细胞一次。
6. 通过在冰上以上升 30%、50% 和 70% 的异丙醇稀释液孵育15 分钟,依次使球体脱水。
7. 在冰上用纯异丙醇孵育球体两次 15 分钟。
8. 从冰中取出载玻片,让它升温至 RT。
9. 执行清除:在 RT 处用纯 ECi 灌注两次。在这个阶段,球体可以避光储存数周,而不会显着损失荧光。
10. 使用共聚焦显微镜的图像球体(参见图 3)。
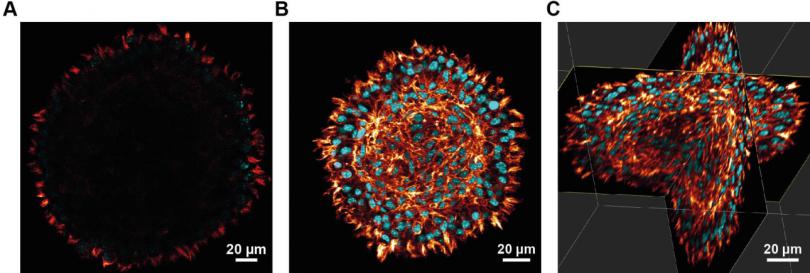
图 3:清除前后染色 L929 球体的共聚焦显微镜(红色:鬼笔环肽,青色:DAPI)。
(A) 清除前的球体。请注意,由于光散射和吸收,只能看到外围细胞,而看不到中心的细胞。(B, C) 清除后的球体。请注意,清洗前后的尺寸差异源于脱水和清洗过程,同一位置的横截面。(B) 横截面 (C) 体积/3D 视图。球体的清除允许即使在球体成纤维细胞的中心也可以看到细胞,同时保留球体的形态。细胞核的计数甚至可以确定形成该球体的细胞数。
点击请查看清除前后染色球体的直接对比视频 (z-stack of 440 slices at a slice spacing of 0.36 µm)。
注:此实验方案来自ibidi的实际用户,更多详情可联系本文作者E-mail address: selina.keppler@tum.de
仅供科研使用!
 微流控细胞灌注套装-细胞与生物学中的液体处理
微流控细胞灌注套装-细胞与生物学中的液体处理
 珀金埃尔默携全线细胞学方案点亮2020ZG细胞生物学会年会@苏州
珀金埃尔默携全线细胞学方案点亮2020ZG细胞生物学会年会@苏州

 评论
评论