文章概述
唐氏综合征(Down syndrome, DS),又称21三体综合征,是一种最常见的智力障碍疾病。已有的研究表明,DS是早发性阿尔茨海默病(Alzheimer’s disease, AD)的重要危险因素之一,几乎所有的DS患者在40岁时都表现出AD神经病理,大约2/3的DS患者在60岁时出现AD症状。21号染色体编码的基因在AD发病机制中起着关键作用,包括引起淀粉样蛋白前体(Amyloid Precursor Protein, APP)的基因拷贝数增加、促进病理性淀粉样蛋白生成等。21号染色体上的泛素特异性蛋白酶USP25的基因能够调节AD中小胶质细胞稳态,但是,USP25是否会影响淀粉样蛋白的病理过程目前仍不清楚。2022年3月1日,厦门大学以及温州医科大学的研究团队在《The Journal of Clinical Investigation》期刊上发表题为“USP25 inhibition ameliorates Alzheimer’s pathology through the regulation of APP processing and Aβ generation”的研究论文,该文章证实,USP25可通过减少APP和BACE1(APP剪切酶)的泛素化以及溶酶体降解,促进了APP的剪切以及Aβ的生成。该研究的结果揭示了从DS发展到AD的关键机制,同时提供了一种潜在的改善AD病理的新策略。

核心观点
1、21号染色体三体加重了5×FAD小鼠(一种AD小鼠模型)大脑中的淀粉样蛋白病变;
2、过表达USP25增加了5×FAD小鼠脑内淀粉样蛋白沉积,而USP25基因缺失则减少了小鼠脑内淀粉样蛋白沉积;
3、USP25通过减少APP和BACE1的泛素化以及溶酶体降解,从而促进APP的切割和Aβ的生成;
4、利用药理学手段抑制USP25可以改善5×FAD小鼠大脑中淀粉样蛋白病理。
研究结果分析
1. USP25基因拷贝数增加可加重AD小鼠淀粉样蛋白的病理改变
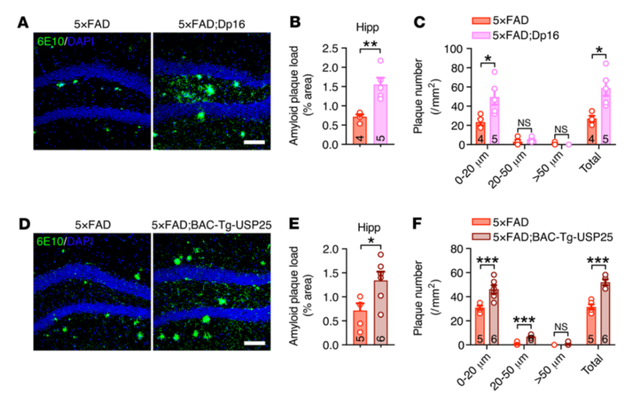
为了研究21号染色体三体是否影响了AD的病理,研究者通过利用5×FAD 小鼠和Dp16 小鼠(一种DS小鼠模型)进行杂交,形成了一种DS-AD联合小鼠模型。利用免疫印迹分析证实,与5×FAD 小鼠相比,DS-AD小鼠皮质中USP25、APP和APP-羧基末端片段(APP- CTFs)的表达明显上调。组织免疫荧光结果显示,在5月龄的DS-AD小鼠海马中,病理性的淀粉样斑块沉积更加显著。考虑到USP25 基因位于21号染色体上,为了确定USP25是否影响DS-AD背景下的淀粉样蛋白病理,研究者5×FAD小鼠与BAC-Tg-USP25小鼠(USP25过表达小鼠)杂交。组织免疫荧光结果显示,在6月龄的5×FAD:BAC-Tg-USP25小鼠海马中,其病理性淀粉样蛋白斑块数量较5×FAD小鼠显著增加,这表明将USP25基因本身拷贝数上调就足以加重AD小鼠的Aβ的病理。
2. Usp25基因缺陷可缓解AD小鼠淀粉样蛋白病理
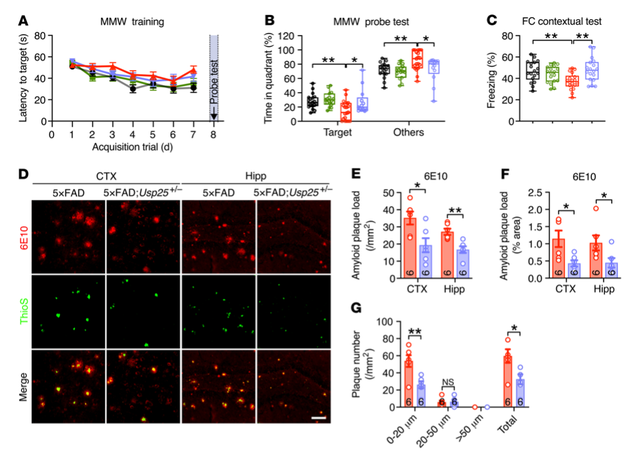
与同窝野生型(Wild Type, WT)小鼠相比,Usp25 -/-小鼠没有表现出体重和认知行为异常。但是,对于Usp25基因缺陷是否会影响淀粉样病变仍是未知的。通过将Usp25+/-小鼠与5×FAD小鼠杂交,产生了5×FAD:Usp25+/-小鼠。研究者评估了5×FAD:Usp25+/-小鼠的学习记忆能力,发现Usp25基因缺陷改善了AD小鼠在水迷宫测试和条件恐惧测试中的认知表现。随后,研究者检测了AD小鼠淀粉样蛋白斑块沉积情况,与5×FAD 小鼠相比,6月龄的5×FAD:Usp25+/-小鼠皮质和海马中淀粉样蛋白斑块沉积减少;并且通过ELISA检测到,AD小鼠Usp25下调能够显著降低皮层和海马中可溶性Aβ40和Aβ42的水平。此外,高尔基染色结果显示,5×FAD小鼠皮质中树突棘存在缺陷,而5×FAD:Usp25+/-小鼠中得到恢复。这些结果表明,Usp25表达下调能够缓解5×FAD小鼠的淀粉样蛋白病理和突触缺陷。

3. USP25能够调节淀粉样蛋白APP的加工过程
Aβ的产生源于β和γ分泌酶对跨膜前体APP的剪切。为了确定USP25下调引起的淀粉样蛋白沉积的减少是否源于APP加工过程的改变,研究者通过免疫印迹分析对APP加工通路中各种蛋白表达进行了表征。结果显示,Usp25缺乏降低了6月龄5×FAD:Usp25+/-小鼠皮质中APP及其剪切产物(α-和β- CTFs)的水平;而过表达USP25显著增加了6月龄BAC- Tg-USP25小鼠皮质中APP和BACE1的表达。
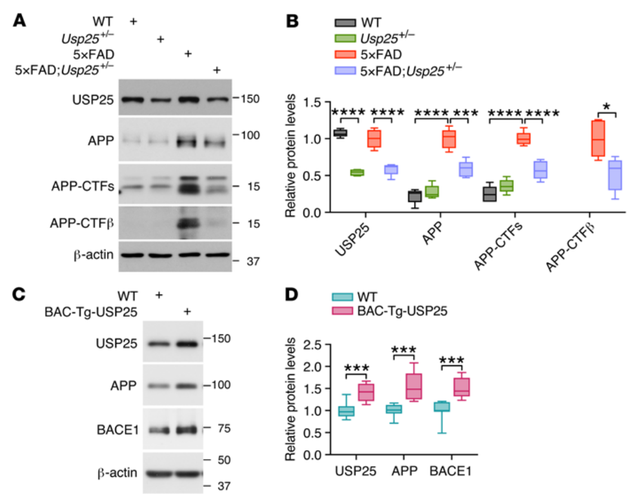
与在体实验结果一致,在人源过表达APP的SH-SY5Y-APP751细胞中,敲除USP25能够显著减少细胞内Aβ40和Aβ42的分泌。此外,敲除USP25能够减少APP、APP-CTFs、sAPPβ、BACE1的表达。另外,在APP过表达HEK293T细胞中过表达USP25能提高APP蛋白水平。抑制溶酶体降解能够废除过表达USP25所引起APP的改变。并且过表达USP25还会导致BACE1的表达增加,而过表达泛素则会降低BACE1表达水平,这表明USP25通过BACE1的泛素化来调控BACE1的表达。这些结果表明,USP25通过上调淀粉样蛋白加工通路的各种成分,如APP和BACE1,来增加Aβ的积累。

4. USP25促进BACE1的去泛素化和APPβ的剪切
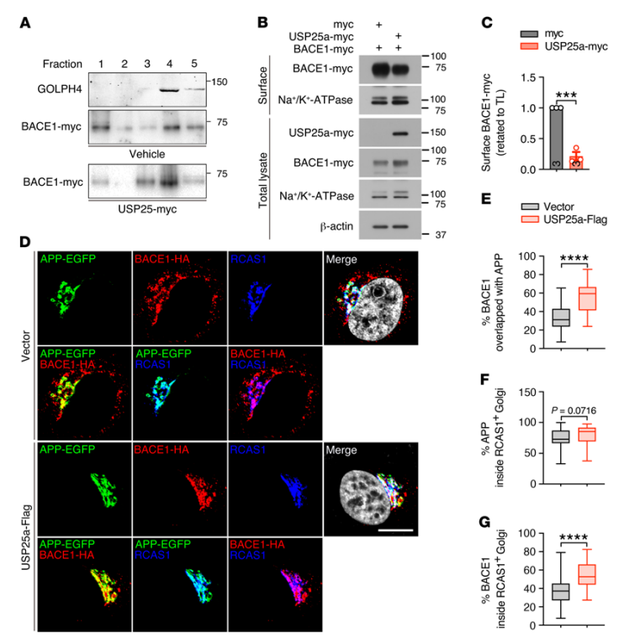
为了确定USP25调控APP加工和Aβ生成的潜在分子机制,研究者进一步验证了USP25与APP以及BACE1之间的相互作用。USP25过表达减少了APP多聚泛素化的数量,而USP25敲除增加了BACE1多聚泛素化的水平。并且通过耗竭USP25介导的APP和BACE1降解可被抑制蛋白酶体和溶酶体降解途径所逆转。
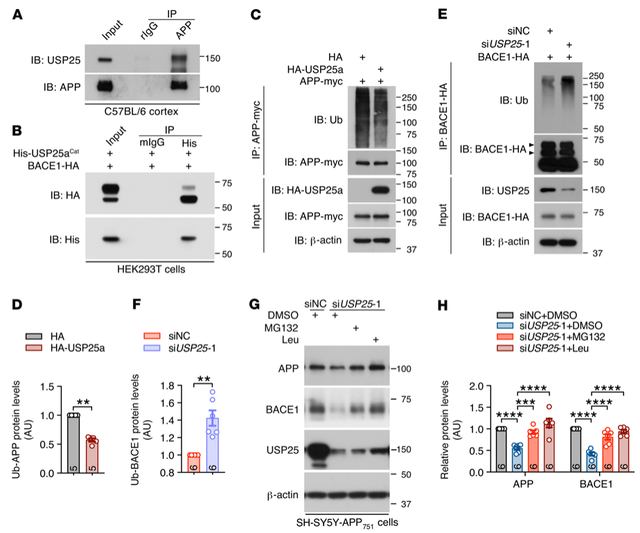
此外,研究者利用梯度蔗糖进行了亚细胞分离,发现USP25过表达增加了BACE1在高尔基体中的积累。为了进一步证实USP25对BACE1转运的影响,研究者利用质膜分离实验,观察到USP25过表达显著减少了细胞表面BACE1的分布,进一步的免疫染色分析显示,过表达USP25后,BACE1进入RCAS1阳性高尔基体比例增加,BACE1与APP共定位的比例增加。这些研究结果表明APP和BACE1是USP25底物,这些成分的转运/加工可以通过USP25介导的去泛素作用来调控。
5. 抑制USP25可改善AD小鼠的淀粉样病变
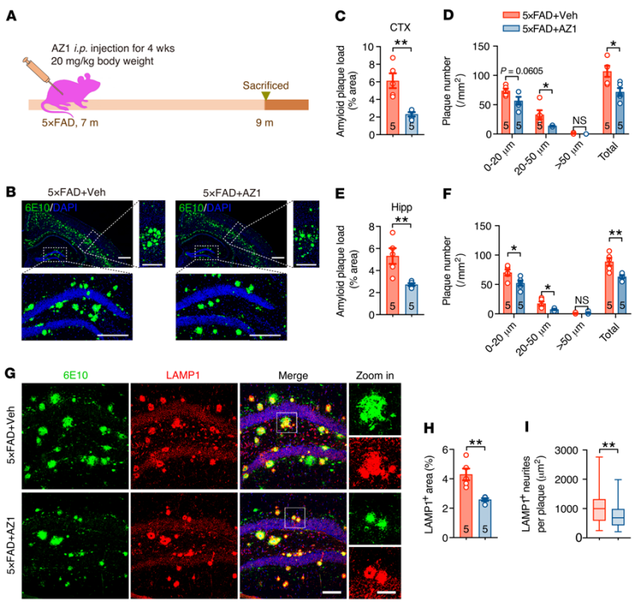
研究者利用重组的USP25体外催化系统找到了一个可以强力抑制USP25酶活性的化合物AZ1。进一步的免疫印迹分析证实,AZ1能够显著降低了5×FAD小鼠皮质中APP和APP- CTFs的含量。为了评价抑制USP25对体内淀粉样蛋白沉积的作用,研究者在5×FAD小鼠腹腔连续注射USP25抑制剂AZ1(20 mg/kg/d,28天)。随后,通过组织学分析,观察到注射AZ1的5×FAD小鼠大脑中淀粉样蛋白斑块的数量有所减少。并且,AZ1也会减少LAMP1和ATG9A表达阳性的营养不良神经突的数目。这些结果表明,通过药物抑制USP25活性可以改善AD小鼠模型中淀粉样蛋白的负荷。
6. USP25的表达与AD患者大脑病理变化相关
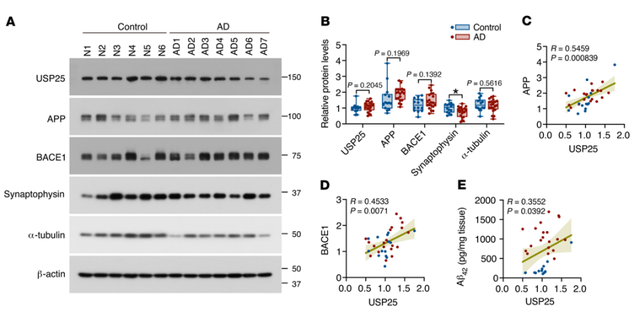
研究者进一步利用AD患者和年龄相匹配的对照组的临床尸检样本比较了大脑中USP25表达水平,偶发性AD患者大脑中USP25蛋白的水平与对照组并无差别;然而利用Spearman相关分析发现,AD患者皮质中USP25和APP、BACE1以及Aβ42之间的量存在正相关。提示USP25介导的淀粉样蛋白通路在AD发病机制中的潜在作用。
总结
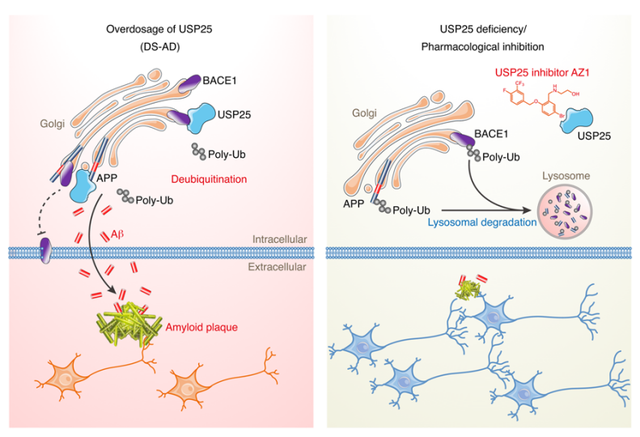
由于泛素-蛋白酶体系统是所有细胞中主要的蛋白质降解途径,因此泛素-蛋白酶体系统的功能障碍可导致多种神经退行性疾病,包括AD、DS、帕金森病和亨廷顿病。该研究证实了21号染色体三体加剧了DS-AD小鼠模型中AD相关的淀粉样蛋白的病变。USP25除了会扰乱小胶质细胞的稳态,还可以通过调节APP加工和Aβ生成在淀粉样蛋白的沉积中发挥作用。此外,利用药理学手段抑制USP25逆转了5×FAD小鼠大脑中淀粉样蛋白的病理进展,提示抑制USP25活性可能是减轻AD淀粉样蛋白沉积的有效策略。总之,该研究结果表明,DS相关的USP25通过调节APP的加工和降解,在AD相关的淀粉样蛋白病理中发挥作用,这也为AD的治疗(尤其是DS患者中)提供了一个潜在的药理学靶点。
亮点研究方法
这项工作为了阐述USP25在AD淀粉样病理中的作用机制,用到了细胞培养、WB、免疫共沉淀、免疫组化等多种细胞分子研究手段以及行为学评估。瑞沃德深耕神经科学研究领域近20年,一直致力于为客户提供可信赖的解决方案和服务,可提供的该研究中涉及的细胞培养、免疫组化以及行为学的完整解决方案。截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全 球700+医院,1000+科研院所,6000+高等院校,已助力全 球科研人员发表SCI文章12000+,获得行业广泛认可。

 锘海LS18平铺光片显微镜助力透明化三维成像技术研究电针治疗多囊卵巢综合征
锘海LS18平铺光片显微镜助力透明化三维成像技术研究电针治疗多囊卵巢综合征
 Neuron:脊髓神经元调控伤害性热刺激感受新机制
Neuron:脊髓神经元调控伤害性热刺激感受新机制

 评论
评论