摘要
基于细胞的体外预测模型可能支持国际上开发新疫苗和其他治疗肺相关疾病(如 COVID-19、慢性阻塞性肺病或特发性肺纤维化)的努力。将3D生物制造与气液界面培养相结合,可以对组织模型进行工程改造,从而在体外重现健康和患病状态下呼吸道的典型特征。这些模型不仅提供了深入了解病毒与靶位点宿主细胞相互作用的潜在机制的机会,而且还有助于减少未来研究中使用的动物数 量,从而支持 3Rs(替换、减少和细化)原则。在这项研究中,我们描述了 3D 生物制造气道上皮模型的生成及其生理相关性的评估。该模型的特点是血管紧张素转换酶 2(ACE2) 的表达,ACE2 是冠状病毒内化所需的一种蛋白质。 ACE2蛋白定位于顶膜表明上皮细胞是极化的,粘蛋白5AC蛋白的存在表明该模型可以产生气道表面液体,这是气道上皮细胞的一种生理功能。因此,这些生物工程组织模型可用于开发不同的疗法和疫苗。
介绍
2019年底出现的新型冠状病毒病(COVID-19)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的。 该病毒具有高度传播性,并使用血管紧张素转换酶 2 (ACE2) 作为主要受体进入哺乳动物细胞。ACE2 是一种细胞表面蛋白,存在于许多细胞和组织中,包括肺、心脏、血管、肾脏、肝脏和胃肠道(Hamming, 2004)。 ACE2 在健康肺组织中适度表达,在慢性阻塞性肺病 (COPD)、特发性肺纤维化(IPF)、哮喘、糖尿病和高血压等病理状况中高度表达 (Saheb Sharif-Askari, 2020)。 众所周知,SARS-CoV-2 会感染呼吸道并传播到整个人体,导致多器官感染症状(de Melo,2021 年)。 因此,由于病毒对人类健康的严重影响,开发新的诊断方法、疫苗和抗病du药物迫在眉睫。
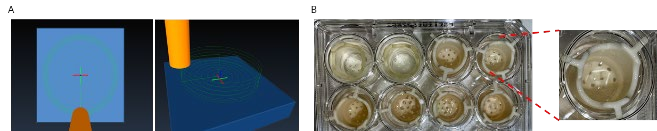
图 1. (A) 使用 CAMotics 的 3D 生物打印模型图示,俯视图(左)和侧视图(右)。 (B) 3D 生物打印肺组织模型转移到 Transwell 插入物。
体外模型对于了解疾病机制以及在临床试验前验证治疗方法至关重要。 尽管目前的 2D 培养模型在筛选病毒复制、感染和药物筛选方面很常见,但它们无法概括组织的复杂性和生理学。 然而,像 3D 生物打印技术这样的新平台可以生成在分子组成、生物力学和复杂性方面更类似于原位组织的组织模型(Singh,2020;Seyfoori,2021)。 这些 3D 生物打印模型可以更好地了解类似于人体器官的微环境中潜在的宿主-病原体相互作用,从而有助于筛选针对肺部疾病(如COVID-19)的药物。
在这项研究中,我们专注于生物打印原代人支气管上皮细胞或 Calu-3 细胞以生成气液界面 (ALI) 模型。Calu-3 是一种分化良好且具有特征的细胞系,来源于人支气管黏膜下腺 (Zhu, 2010)。 人肺的黏膜下腺是气道表面液体、粘蛋白和其他免疫活性物质的主要来源。
生物打印的肺病模型在 Transwell 插入物中培养 14 天,并对 ACE2 和粘蛋白 5AC (MUC5AC) 蛋白进行免疫染色。 使用本应用说明中介绍的实验装置,可以研究宿主-病原体与 SARS-CoV-2 和气道上皮细胞的相互作用(Zhu,2010)。

图 2. 第 7 天 (D7) 和第 14 天 (D14) 肺组织模型在 10 倍放大时的 H&E 染色。 位于构建体顶部的 Calu-3 和 HBE 细胞的上皮层。 比例尺=100 µm。
材料和模型
细胞准备
在肺组织模型中使用了两种不同的上皮细胞类型:人支气管上皮细胞(HBEpC;C-12640,PromoCell)和 Calu- 3(肺腺癌细胞衍生的上皮细胞;HBT-55,ATCC)。人肺成纤维细胞(HPF;C-12360,PromoCell)用作支持细胞。 在根据各自制造商的协议进行生物打印之前,将细胞解冻并在 2D 中扩增。 HBEpC在气道上皮细胞生长培养基(C-21060,PromoCell)中培养,HPF在补充有生长培养基2试剂盒(C-23020,PromoCell)的成纤维细胞生长培养基2中培养,分别用于第4代和第9代; 而 Calu-3 细胞在补充有 10% 胎牛血清 (FBS; 10270106, Gibco Thermo Fisher Scientific) 和 1% 青霉素-链霉素-新霉素混合物 (PSN; 15640055,Gibco Thermo Fisher Scientific)并用于第 4 段。
肺组织模型的生物打印
肺模型被设计成一个圆盘,底部有一个实心层,顶部有一个 5 层边缘(图 1A、1B)。 这样做是为了促进接种后上皮细胞的包埋。 该磁盘是用 GelMA-Laminin 521 (GelMA-LN521, CELLINK) 3D 打印的。 接下来,将 2 x 106 HPF 用胰蛋白酶消化、洗涤、收集、旋转并轻轻重悬于 100 µL 成纤维细胞培养基 2 中,然后将其小心地混合到1mLGelMA-LN521生物墨水中,预热至37°C并转移到琥珀色墨盒中( CSO010311502,CELLINK)。 为了去除截留的气泡,将嵌入 HPF 的 GelMA-LN521 滤芯以 460g 离心 1 分钟。 在开始打印会话之前,将墨盒安装在 BIO X™ 生物打印机中设置为 27°C 的温控打印头(00000020346,CELLINK)中 20 分钟。 将药筒倒置 2 至 3 次以避免细胞沉淀。 GelMA-LN521 生物墨水的合适生物打印温度为 26°C 至 27°C。然后在 12 孔板中使用温控打印头在 27°C 下对圆盘篮进行生物打印。 首先使用 405 nm 光固化模块(距离设置为 5 厘米)对每个构建体光固化 12 个圆盘复制品,并将成纤维细胞生长培养基添加到每个孔中。 然后在添加上皮层之前,将圆片在成纤维细胞生长培养基中于 37°C 孵育 3 天。
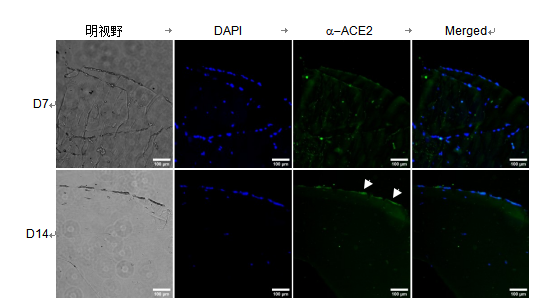
图 3. HBE 细胞中 ACE2 的免疫染色。 在 ALI 培养的构建体上不同天的 ACE2(绿色)和细胞核染色 DAPI(蓝色)。 比例尺=100 µm。
增加肺上皮层
对于上皮层,将 HBE 或 Calu-3 细胞分别重悬于气道上皮生长培养基或 MEM 完全培养基中,并补 3充 5 ug/mL LN521。将 150K 细胞/cm2 接种在每个圆盘的顶部。从孔中取出成纤维细胞培养基,将5 x 105 个细胞重新悬浮在 360 μL 的完全培养基中,并在每个圆盘的顶部添加 30 μL 的细胞悬浮混合物。接种后将构建体留在工作台上 10 分钟,然后转移到培养箱中再放置 20 分钟以使细胞附着在生物打印盘上。将 HBE 构建体以 1:9 的比例轻轻浸入成纤维细胞和气道上皮培养基的混合物中;将 Calu-3 构建体以 1:9 的比例浸入成纤维细胞和 MEM 培养基的混合物中。浸没培养物在37°C、5% CO2 下生长 4 天,然后转移至 ALI 培养物。 ALI 培养是通过将结构转移到 Transwell 插入物中来建立的,该插入物补充了适当体积的相同介质,如上所述(图 1B)。培养基每 2 至 3 天更新一次。
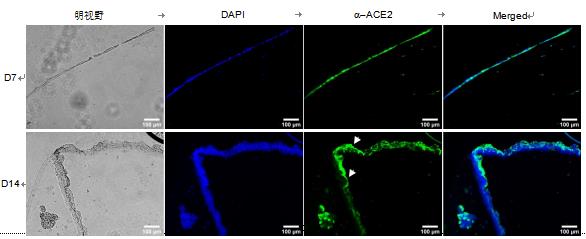
图 4. Calu-3 细胞中 ACE2 的免疫染色。 细胞在 ALI 培养物中的 GelMA-LN521 上生长。 在第 7 天 (D7) 和第 14 天 (D14),对细胞进行固定、切片和 ACE2 染色(绿色)。 使用 DAPI(蓝色)可视化细胞核。 构建体在明场中可视化以查看 ALI。 比例尺 = 100 µm。
分析
根据 CELLINK 的固定方案,在第 7 天和第 14 天(ALI 培养)收集样本,并在 4% 多聚甲醛 (PFA) 中固定进行组织学染色。 然后将样品包埋在石蜡中,按照 CELLINK 的切片协议,使用切片机获得10 µm 切片。 按照 CELLINK 的免疫荧光方案并使用 Alexa Fluor 488(A-11029,Thermo Fisher Scientific)作为二抗,对切片进行 ACE2(MAB933,R&D Systems)和 MUC5AC(AB3649,Abcam)染色。 样品也按照 CELLINK 的方案进行了 H&E 染色。 所有协议都可以在 CELLINK 网站的 Support 选项卡下找到。
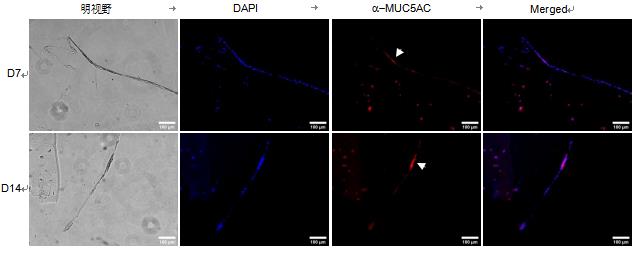
图 5. HBE 细胞中粘蛋白的免疫染色。 细胞在 ALI 培养物中的 GelMA-LN521 上生长。 在第 7 天 (D7) 和第 14 天(D14),细胞被固定、切片并染色 MUC5AC(红色)。 使用 DAPI(蓝色)可视化细胞核。 构建体在明场中可视化以查看ALI。 比例尺 = 100 µm。
结果与讨论
用于生成肺组织模型的制造方法创建了一个完整且坚固的构造,在整个实验过程中保持其形状。 样品横截面的H&E 染色显示,接种在构建体顶部的 Calu-3 和 HBE 细胞在第 7 天形成了紧密的单层。然而,在第 14天,Calu-3 细胞形成了厚的多层上皮样 结构,而 HBE 细胞仍然保持薄的单层(图 2)。 这表明初级支气管上皮细胞保持了接触抑制,这种抑制在癌细胞中丢失,导致细胞相互重叠生长。
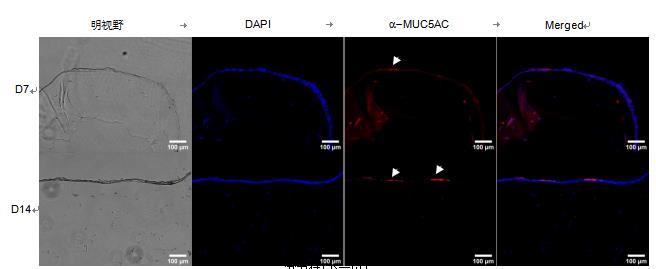
图 6. Calu-3 细胞中粘蛋白的免疫染色。 细胞在 ALI 培养物中的 GelMA-LN521 上生长。 在第 7 天 (D7) 和第 14 天 (D14),细胞被固定、切片并染色 MUC5AC(红色)。 使用 DAPI(蓝色)可视化细胞核。 构建体在明场中可视化以查看 ALI。 比例尺 = 100 µm。
接下来,我们对 ACE2 进行了免疫染色,ACE2 是一种参与冠状病毒内化的细胞表面蛋白。在 HBE 样本中,在第 7 天单层中很少有细胞对 ACE2 进行染色,而在第 14 天,在许多细胞中检测到 ACE2 染色(图 3)。与HBE 不同,Calu-3 样本中的大多数细胞在第 7 天和第 14 天都对 ACE2 进行了染色(图 4)。此外,在顶端膜域(ALI 培养中的空气表面)观察到 ACE2 的免疫染色,如在第 14 天样品中朝向顶部 Calu-3 细胞的局部绿色信号所见(图 4),表明细胞层是极化的。这些数据一起表明,我们的 Transwell 模型显示了极化的气道上皮细胞,在原代细胞和癌症衍生细胞中都表达了 ACE2。
为了进一步表征模型,我们对 ALI 培养结构中的粘蛋白进行了免疫染色,因为据报道 MUC5AC 是由气管支气管表面上皮中的杯状细胞产生的 (Kesimer, 2009)。我们在 ALI 培养模型中观察到 MUC5AC 在 HBE 和 Calu- 3 细胞中的表达(图 5、6),表明细胞已经分化。我们的数据共同表明,这里介绍的 3D 生物制造模型将为设计 3D 肺组织模型提供一个极好的工具,以快速筛选针对 COVID-19 的生物制剂。这也将有助于减少动物研究,从而支持 3R 原则。
结论
该研究表明,3D 生物打印与 Transwell 细胞培养相结合可用于生成复杂的体外肺上皮模型。
* 体外 ALI 模型显示 ACE2 和 MUC5AC 蛋白的表达。
* 原代支气管上皮细胞在整个实验过程中保持紧密的单层,而 Calu-3 细胞在第 14 天形成多层上皮。
* 与腺癌细胞来源的 Calu-3 细胞系相比,ACE2 在原发性支气管上皮细胞中的表达中等。
* ALI 培养中生长的细胞变得极化,如培养物顶膜上 ACE2 的表达所见。
参考文献
Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis GJ, van Goor H. Tissue distribution of ACE2 protein,the
functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. The Journal of Pathology. 2004; 203(2): 631–637. DOI:10.1002/path.1570.
SahebSharif-Askari N, Saheb Sharif-Askari F, Alabed Airways expression of SARS-CoV-2 receptor, ACE2, and TMPRSS2 is lower in children than adults and increases with smoking and COPD. Molecular Therapy – Methods & Clinical Development. 2020; 18: 1–6. DOI:10.1016/j.omtm.2020.05.013.
de Melo BAG, Benincasa JC, Cruz EM, Maricato JT, Porcionatto MA. 3D culture models to study SARS-CoV-2 infectivity and antiviral candidates: From spheroids to bioprinting. Biomedical Journal. 2021; 44(1): 31–42.DOI:10.1016/j.bj.2020.11.009.
SinghAK, Mishra G, Maurya A, Kulkarni GT, Awasthi Biofabrication: An interesting tool to create in vitro model for COVID-19 drug targets. Medical Hypotheses. 2020; 144: 110059. DOI:10.1016/j.mehy.2020.110059.
SeyfooriA, Amereh M, Dabiri SMH, Askari E, Walsh T, Akbari The role of biomaterials and three dimensional
(3D) in vitro tissue models in fighting against COVID-19. Biomaterials Science. 2021; 9(4): 1217–1226. DOI:10.1039/D0BM01616K.
ZhuY, Chideke lA, Shaffer Cultured human airway epithelial cells (Calu-3): A model of human respiratory function, structure, and inflammatory responses. Critical Care Research and Practice. 2010: 394578. DOI:10.1155/2010/394578.
KesimerM, Kirkham S, Pickles Tracheobronchial air-liquid interface cell culture: a model for innate mucosal defense of the upper airways? American Journal of Physiology-Lung Cellular and Molecular Physiology. 2009; 296(1): L92–L100. DOI:10.1152/ajplung.90388.2008.
 扒开新型冠状病毒的外衣
扒开新型冠状病毒的外衣
 珀金埃尔默推出用于新冠病毒高通量检测的模块化、可扩展explorer™自动化
珀金埃尔默推出用于新冠病毒高通量检测的模块化、可扩展explorer™自动化

 评论
评论