细胞划痕实验(Wound Healing)是一种操作简单,经济实惠的研究细胞迁移/肿瘤侵袭的体外试验方法。为了研究细胞迁移的机制,科学家们传统上转向“划痕试验”,它利用移液器尖端在多孔板中的单层细胞上“划痕”,并观察间隙所需闭合的时间(这些有时也被称为“伤口闭合”或“伤口愈合”分析)。这种类型的实验允许分析细胞迁移,并可以用各种药物和化学品来增强,以阐明特定的机制。
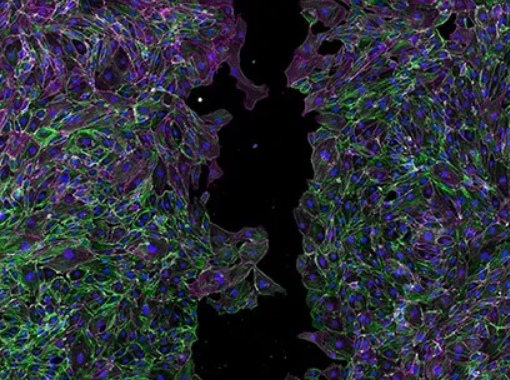
在 ibidi 35mm µ-Dish 中培养的内皮细胞,预置2-Well Culture-Insert。移除插件后,让细胞迁移 24 小时,然后固定在 4% PFA 中,并进行透化。VE-钙粘蛋白(洋红色)、 F-肌动蛋白用鬼笔环肽(绿色)和细胞核用DAPI(蓝色)的抗体染色,然后进行共聚焦成像。
Derek Sung, University of Pennsylvania School of Medicine:
我一直都有进行划痕分析。与大多数体外测定类似,一致性是获得准确和可重复结果的关键。作为进行过无数次此实验的人,使用移液器手动创建间隙存在一些过去给我带来麻烦的关键问题。这就是为什么发现 ibidi Culture-Inserts是一种救星。ibidi 细胞培养插件与传统的划痕检测方法相比具有许多优势:
1. 标准的间隙距离
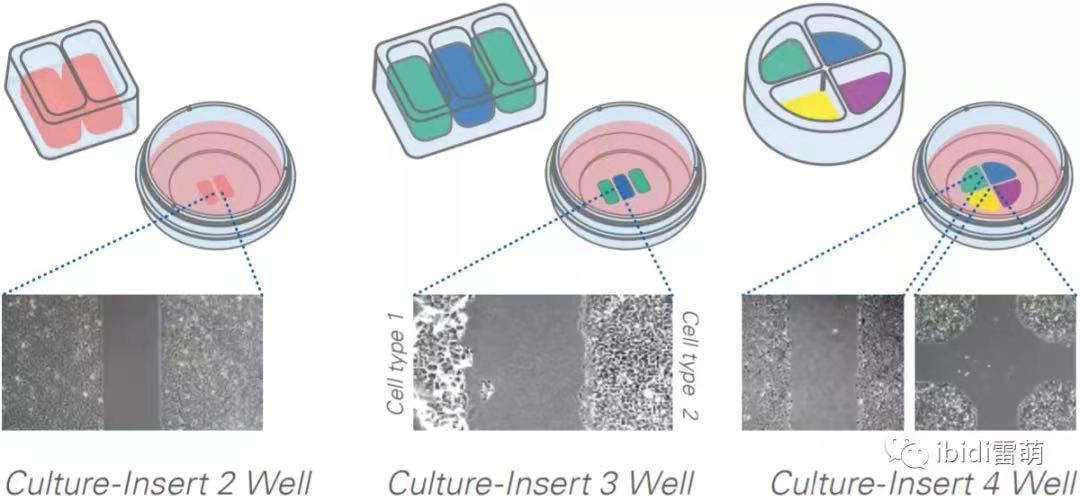
传统划痕分析和使用移液管手动划痕大挑战之一是间隙距离不一致。而且,划痕往往划不直。因此,起始距离通常会在几十到几百微米之间变化。ibidi 的细胞培养插件中心会产生500 µm 无细胞的人造间隙。这确保了间隙是直的,并且每次的距离都是一致的。

2. 干净的迁移边缘
手动划痕还会产生未完全去除的自由浮动细胞的问题。这些自由漂浮的细胞可以通过延迟自由边缘的迁移、释放细胞内内容物或重新附着来影响迁移率。ibidi 的细胞培养插件是可移除的,留下干净笔直的边缘。
3. Z小化细胞数
传统的划痕检测是在多孔板中完成的,需要一层汇合的细胞。如果实验有多种条件(药物治疗或基因操作)并且需要多次重复,这会需要增加大量细胞。对于珍贵或昂贵的细胞(例如从难以获得的组织中分离出的原代细胞),这些实验可能变得难以进行。ibidi 的细胞培养插件具有较小的生长面积,可大限度地减少实验所需的细胞数量(准确地说,每孔0.22 cm 2)。这允许大限度地利用宝贵的细胞或增加重复次数。
4. 盖玻片底皿
划痕分析通常在多孔板中进行,底部厚,聚苯乙烯,只允许明场成像和间隙距离的量化。ibidi 的细胞培养插件具有经过组织培养处理和灭菌的盖玻片底部。这允许进行明场和免疫荧光成像。就我个人而言,我认为这是该产品好的方面,让我们能够看到如细胞骨架、细胞粘附形态、核形态等结构。此外,多模态成像功能大限度地提高了单个实验的数据量,从而节省了成本和试剂。
5. 单个实验的独立插件
“边缘效应”是指一种细胞培养现象,其中多孔板外周的孔比内孔经历更多的蒸发,导致不同的条件和潜在的不一致结果。使用多孔板进行划痕检测时可以看到类似的效果,影响结果的一致性和重现性。ibidi 的细胞培养插件单独包装,用于单次实验。这可以防止任何“边缘效应”并确保数据一致。另外,培养皿设计有盖子锁定功能,以确保在处理盘子时盖子保持打开状态。
与枪头划痕检测相比,ibidi 伤口愈合插件可提供更高的重现性
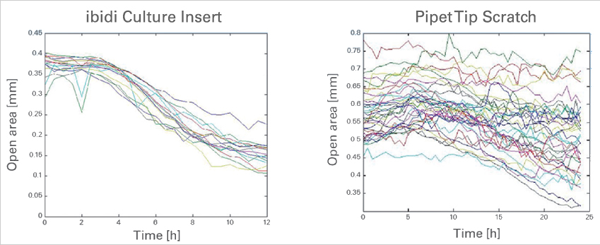
由于细胞迁移开放区域随时间发生变化。使用 ibidi Culture-Insert 2 孔(左)和用移液器吸头刮擦产生间隙的对比。数据来源:德国弗莱堡大学的 M. Börries。
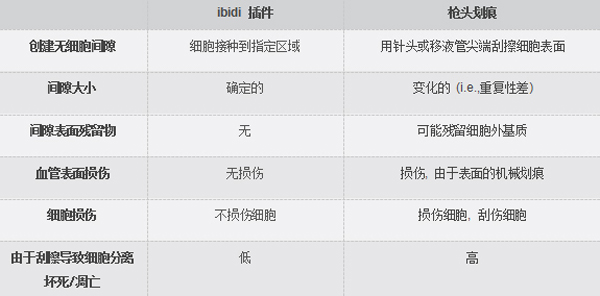
乍一看,枪刮和放置插件的方法似乎是两种非常相似的创建无细胞间隙的方法。 然而,仔细观察,这两种方法可能在重要检测结果方面的影响有所不同:

 ibidi Culture-Inserts的应用|胎盘发育和病理分子的研究
ibidi Culture-Inserts的应用|胎盘发育和病理分子的研究
 微流控细胞灌注套装-细胞与生物学中的液体处理
微流控细胞灌注套装-细胞与生物学中的液体处理
 珀金埃尔默携全线细胞学方案点亮2020ZG细胞生物学会年会@苏州
珀金埃尔默携全线细胞学方案点亮2020ZG细胞生物学会年会@苏州

 评论
评论