脂质体是由同心磷脂双分子层组成的磷脂囊泡,这些双分子层包围起来形成一个水性空间[1](图1所示)。磷脂尾由两条疏水的长脂肪酸链组成,它们聚集在一起以ZD限度地减少与水分子的相互作用,即疏水作用。脂质体在药物递送领域具有重要的意义,因为其无毒、生物相容性和可生物降解。最重要的是,它们可以通过将药物插入双层的疏水部分或脂质体的水性内部来递送药物[2]。此外,脂质体可以保护药物不被酶降解和被肾脏过滤掉[2]。
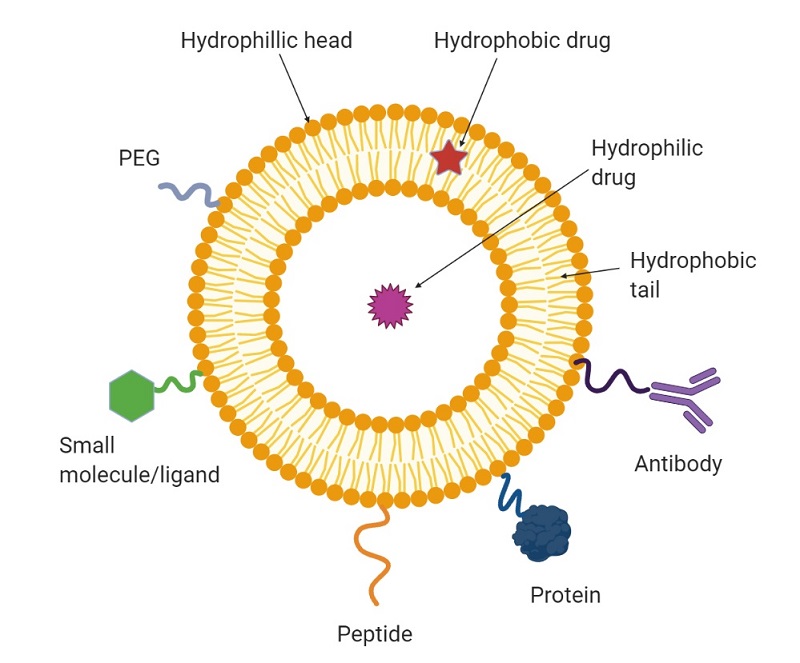
图1 脂质体的结构和修饰以将药物输送到特定细胞
为了将脂质体输送到特定类型的细胞,脂质体需要用抗体、配体[2]或其他蛋白质或肽进行修饰,如图1所示。一旦修饰的脂质体被靶细胞上的特定受体识别,它们就会在称为受体介导的内吞作用的过程中被细胞吸收(图2),从而将药物分子输送到细胞质中[3, 4]。例如,叶酸(一种配体)及其结合受体叶酸结合蛋白(FBP)通常用于研究癌症研究中的药物递送策略,因为FBP在多种人类癌症中过度表达,例如卵巢癌、脑癌、肾和肺[3, 4]。
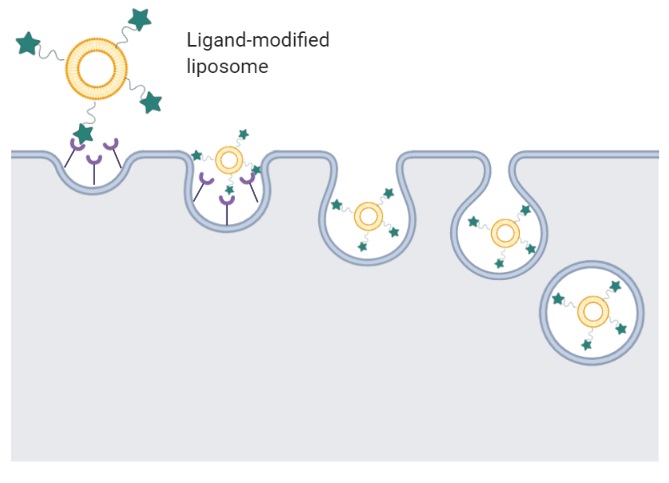
图2 配体修饰脂质体的受体介导的内吞作用。DY个脂质体被放大以清楚地显示配体。在典型的细胞膜上可以看到配体的受体。配体与受体结合后,细胞膜在脂质体周围闭合形成囊泡,将携带药物的脂质体捕获在其中,然后在细胞内进一步加工以将药物释放到细胞质中。
聚乙二醇(PEG)是众所周知的一种物质,通常用于防止蛋白质的表面吸附[5]。对于脂质体的应用,通常添加PEG以延长脂质体在人体内的循环时间,因为没有它,未修饰的脂质体将在几小时内被参与免疫反应的吞噬细胞清楚[2, 3]。这是因为PEG的存在阻止了吞噬细胞的非特异性吸附,例如[3]。然而,用PEG修饰脂质体的缺点是由于空间位阻,它可能会降低脂质体上的配体与其特异性受体结合的能力。因此,必须在延长脂质体循环时间和ZD化脂质体向靶细胞的递送效率之间进行折衷[2]。
脂质体已固定在表面等离子共振(SPR)传感表面上以研究药物和脂质体的相互作用[6],并作为一种放大策略来降低干扰素和细菌毒素的检测限,例如[7]。以下实验的目的是证明向叶酸修饰脂质体中添加PEG2000会导致与固定在Affinite P4SPR的SPR金传感表面上的FBP的结合降低(图3)。SPR是一种强大的工具,可以实时、无标记地表征修饰的脂质体。此外,实验室内使用P4SPR仪器可以让研究人员即时执行实验优化,而不是多次使用公共测试ZX的设备进行反复测量,这节省了大量的宝贵时间。
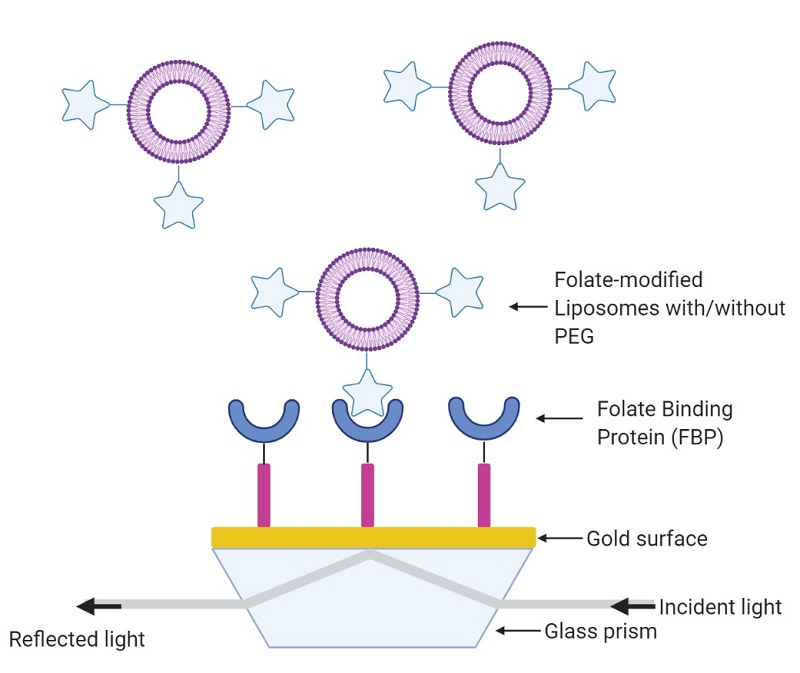
图3 使用Affinite的P4SPR检测聚乙二醇化和非聚乙二醇化叶酸修饰脂质体的方案
实验步骤
使用P4SPR在静态条件下测量SPR。为了固定叶酸受体,通过在MilliQ水中注射500 μL的EDC:NHS 20:5mM来激活16-MHA涂层的金棱镜,并反应20分钟。通过注入1mL 100mM磷酸盐缓冲液彻底清洗表面。然后,在由100mM磷酸盐缓冲液(pH=5)、4mM巯基乙醇和10% v/v 甘油组成的缓冲液中注入300 μL 40nM叶酸结合蛋白(FBP)并反应1小时。FBP固定后,表面用1mL 100mM磷酸盐缓冲液冲洗,以评估生物传感器表面吸附的FBP。注入1mL 1M乙醇胺并反应5min以灭活未反应的NHS基团。传感器用1mL 1×PBS(pH=7.4)冲洗,并注入500μL脂质体样品。所有脂质体悬浮液的浓度为10μM,并固定10min。注入的样品列于表1中,区别仅在于在第二个样品中添加了DOPE-PEG 2000-NH2。在脂质体固定期间,依次用 1 mL 1 x PBS (pH=7.4) 和 1 mL 10 mM 甘氨酸 (pH=1.5) 冲洗表面 5min,ZH用 1 x PBS (pH=7.4)冲洗。
表1
Sample | Mol % DSPE-PEG-Folate | Mol % DOPE-PEG 2000-NH2 |
1 | 0.5 | 0 |
2 | 0.5 | 3.5 |
结果
图4显示了一组初步检测结果,其中显示了每个样品的传感图(sensorgrams)。首先,数据显示P4SPR能够通过叶酸和FBP结合亲和力检测脂质体,如从~60s到~750s(绿色)和~60s和~800s(黑色)的两条关联曲线所示)。此外,可以看到,与未聚乙二醇化的叶酸修饰脂质体样品(~110RU,黑色)相比,聚乙二醇化叶酸修饰的脂质体样品(绿色)的共振单位相对变化(~40RU)较低。这表明脂质体表面PEG的存在因为空间位阻而YZ了叶酸修饰脂质体与FBP修饰传感器表面的一些结合,即PEG阻止脂质体上的叶酸与固定在传感器表面上的FBP的结合。
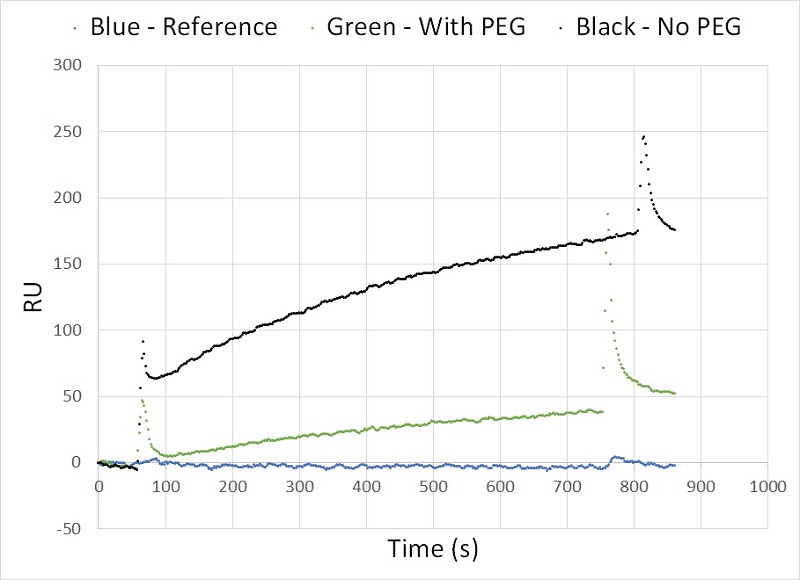
图4 显示了每个脂质体样品获得共振单位的部分传感图
从传感器表面的表面活化和叶酸修饰到脂质体样品的ZZ注射,该实验大约需要3小时才能完成。总SPR运行时间可能更短,因为在初始进样和ZZ进样之间进行了一些样品浓度优化。研究人员可以随时更改实验条件这一事实是在实验室内拥有P4SPR仪器的优势。ZH,即使观察到注射尖峰并且可以优化表面化学和脂质体浓度等其他条件,您可以随时在P4SPR上重复和进一步开发实验。
结论
Affinite P4SPR能够检测叶酸修饰的脂质体,更重要的是,由于PEG引起的空间位阻,可以区分PEG和未聚乙二醇化的叶酸修饰脂质体之间的差异,从而降低叶酸对FBP的亲和力。Affinite P4SPR仪器可用作研究人员的标准检测平台,在进行生物测定或动物实验的进一步测试之前,以快速简单的方式表征脂质体以获得药代动力学特征[8],从而避免浪费宝贵的研究时间、资源和动物。最重要的是,因为不需要使用公共测试ZX的SPR仪器,P4SPR仪器触手可及的加速了脂质体的研究开发,
致谢
我们感谢 Félix Lussier 博士提供传感图数据。 Félix Lussier 博士来自Max Planck Institute医学研究所细胞生物物理学系。
Affinite Instruments P4SPR仪器
Affinité Instruments 的 P4SPR 是一款出色的 SPR 仪器,可以提供高质量的实时数据以满足您的研究需求。 与执行 ELISA 检测相比,它不需要标记或二次反应,并减少了大量宝贵的研究时间。 由于实时监测,它还可以以比 ELISA 更高的灵敏度检测低亲和力相互作用。

参考文献
[1] Parveen Kumar, Peipei Huo, and Bo Liu, “Formulation Strategies for Folate-Targeted Liposomes and Their Biomedical Applications”, Pharmaceutics, 11, 381 (2019).
[2] Robert J. Lee and Philip S. Low, “Delivery of Liposomes into Cultured KB Cells via Folate Receptor-mediated Endocytosis”, J. Biol. Chem., 269, 3198-3204 (1994).
[3] Alberto Gabizon, Aviva T. Horowitz, Dorit Goren, Dina Tzemach, Hilary Shmeeda, and Samuel Zalipsky, “In Vivo Fate of Folate-Targeted Polyethylene-Glycol Liposomes in Tumor-Bearing Mice”, Clin. Cancer Res., 9, 6551–6559 (2003).
[4] Mary Jo Turk, David J. Waters, Philip S. Low, “Folate-conjugated liposomes preferentially target macrophages associated with ovarian carcinoma”, Cancer Lett., 213, 165-172 (2004).
[5] Roger Michel, Stephanie Pasche, Marcus Textor, and David G. Castner, ”The Influence of PEG Architecture on Protein Adsorption and Conformation”, Langmuir, 21, 12327-12332 (2005).
[6] Cheryl L. Baird, Elizabeth S. Courtenay, and David G. Myszka, “Surface plasmon resonance characterization of drug/liposome interactions”, Anal. Biochem., 310, 93-99 (2002).
[7] Agustina Gomez-Hens, Juan Manuel Fernandez-Romero, “The role of liposomes in analytical processes”, Trends Analyt. Chem., 24, 9-19 (2005).
[8] B.J. Crielaard, A. Yousefi, J.P. Schillemans, C. Vermehren, K. Buyens, K. Braeckmans, T. Lammers, G. Storm, “An in vitro assay based on surface plasmon resonance to predict the in vivo circulation kinetics of liposomes”, J. Control. Release, 156, 307-314 (2011).

 评论
评论