考虑到mRNA转录的高度动态特性以及样品处理和下游处理步骤中引入的潜在变量,RT-qPCR工作流程的每个步骤的标准化方法对于可靠和可重现的结果至关重要。MIQE为这种方法提供了一份包含85个参数的清单,以确保质量结果符合任何期刊的接受标准。接下来,小编将为大家详细介绍如何应用MIQE指南来建立一个可靠的RT-qPCR实验流程。
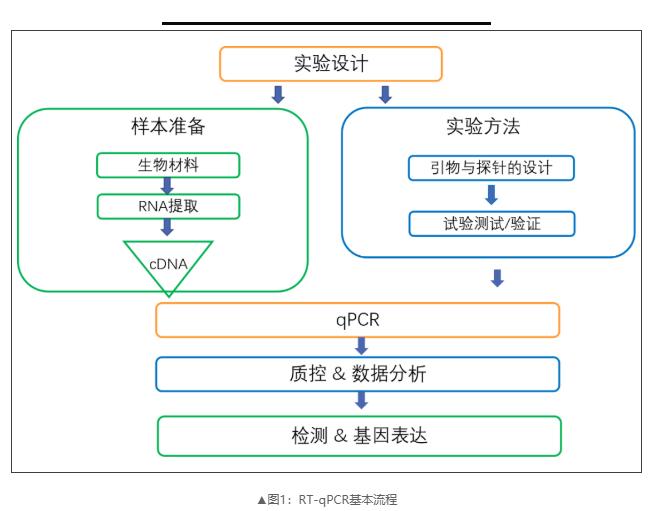
1、实验设计
正确的实验设计是任何基因表达研究的关键。由于mRNA转录对与研究过程无关的外部刺激敏感,因此严格控制和设计实验条件的工作是十分重要的。其中包括了确定实验程序、对照组、重复组的类型和数量、实验条件以及各组内的样品处理方法等,这些对于最小化变异性至关重要(表1)。

2、RNA提取及质控
样品需-80℃冷冻或使用RNA储存溶液进行储存。RNA提取程序应包括DNA酶处理步骤,以去除任何的基因组DNA污染。
确保仅使用高纯度(无污染物)和高完整性(未降解)的RNA是RT-qPCR实验工作流程中最关键的一点。RNA样本中的杂质可能导致RT和PCR的YZ,从而导致不同和不正确的定量结果。由于样品纯度和完整性不相关,因此应评估两者确定RNA样本符合下游工作流程的ZD验收标准。

3、逆转录
考虑到RNA酶在环境中的普遍存在,建议在质量控制评估后立即将总RNA样本反转录成cDNA。这将避免RNA样品在转化为cDNA之前多次冷冻/解冻而降解的风险。对于RT步骤,关键是确保提取的RNA样本中转录基因组的一致性和完整性。建议使用相同数量的总RNA,并保持所有实验样本的反转录反应时间,以最小化生物复制之间的变异性。
4、引物和扩增子设计
引物设计和靶序列的选择是保证扩增产物特异性和GX性的关键。目前有许多软件或在线网站可设计引物对和确定扩增子,比如DNAMAN、Primer Premier、Oligo、Beacon Designer、Primer-Blast、BathPrimer、Primer3 Plus等等。
5、qPCR验证
qPCR验证是使用一组标准样品对引物退火温度、反应效率和特异性的适度范围进行评估的方法。具体步骤如下:
1)根据仪器类型,选择合适的耗材和qPCR试剂;
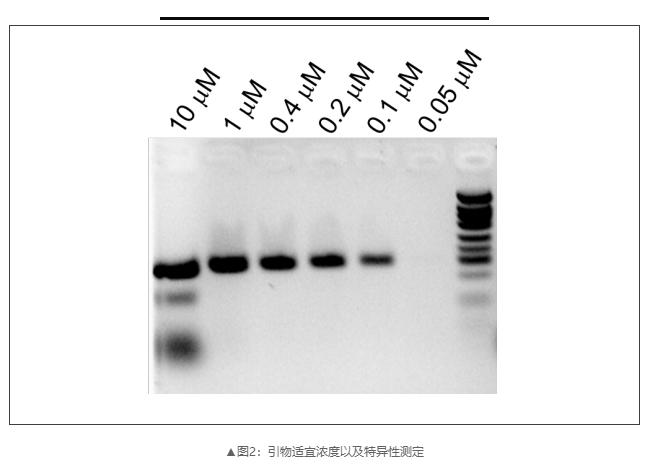
2)配置不同的PCR反应体系,凝胶电泳检测引物适宜浓度以及特异性;
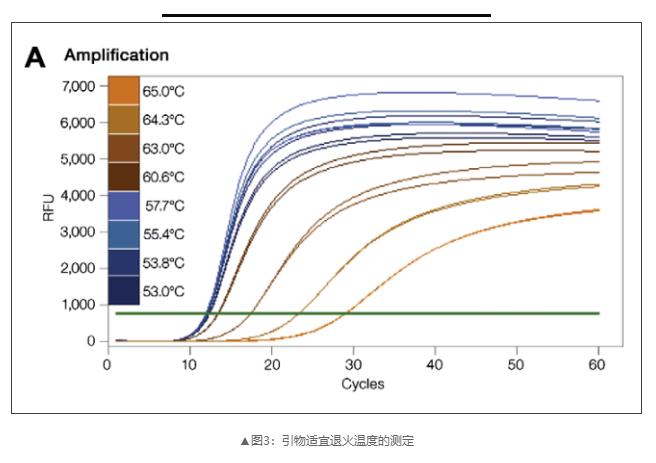
3)设置温度梯度测试引物适宜退火温度;
4)实验设置NTC、NRC、POS和NEG等对照组,来监控实验体系或污染;
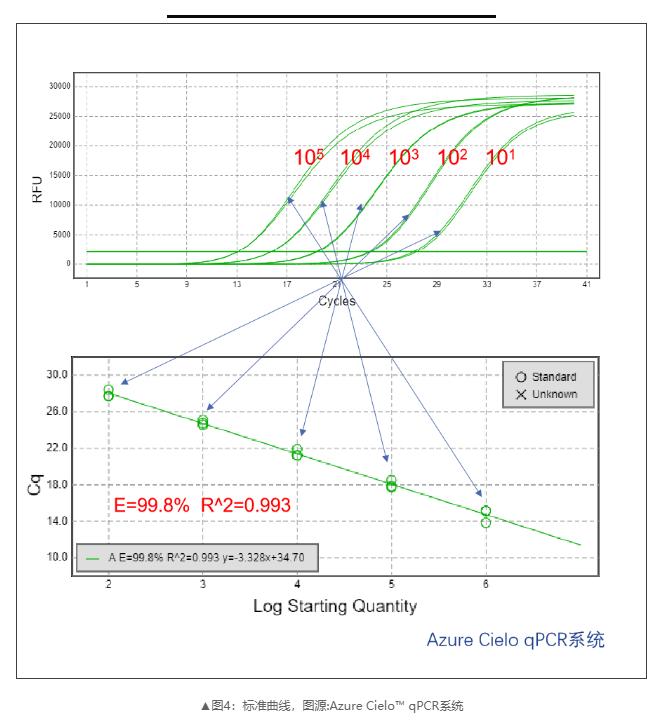
5)标准曲线的建立(评价PCR效率)。
6、内参基因的选择
在RT-qPCR实验中,内参基因可以用于校正上样量、上样过程中存在的实验误差,保证实验结果的准确性。一个好的内参基因应在不同时空样本或不同处理样本中具有相对稳定的表达水平,常见的有ATCB、GAPDH、β-actin、18S rRNA等。
7、实验重复性
基因表达实验中有两种可能影响结果的变异来源:
1)由于个体有机体、组织或细胞样品之间基因表达水平的固有差异引起的生物变异性;
2)实验过程本身的技术变异性,通常与移液器误差、操作误差或样品质量和数量有关。为了减轻生物和技术变异性的影响,一般认为至少三次生物学重复和技术重复。

看完整个RT-qPCR实验流程,您是不是拨开RT-qPCR神秘的面纱了呢,现在快快来申请Azure Cielo™ 实时荧光定量PCR系统,来感受Azure Cielo™带给您的真实可靠的RT-qPCR数据。
Azure Cielo™实时荧光定量PCR系统
Azure Cielo™ 实时荧光定量PCR系统来自美国Azure Biosystems公司,可为您提供3/6检测通道,根据实验需求灵活配置。这款产品采用了高能LED作为光源系统,可保证光源强度高,光源一致性好;高品质的帕尔贴温度模块作为温控系统,升降温速率快,可设置12列跨度30°C的温度梯度;CMOS拍照+光纤信号传输作为检测系统,CMOS检测灵敏度高,光纤传输速度快,无光损失和噪音干扰,无需ROX校准。Azure Cielo™实时荧光定量PCR系统可为您的科学研究提供高灵敏度和高可靠性的实验结果。

 组织透明化方法知多少
组织透明化方法知多少

 评论
评论