微透析技术是一种从细胞间隙中收集小分子量物质的科学技术,在神经科学中广泛应用,是少数几种可量化自由活动动物体内神经递质、肽和激素的技术之一。该方法主要用于脑和外周的神经递质、神经肽以及激素的取样和定量。
微透析工作原理
微透析通过探针内部管道和外部包裹的半透膜进行物质交换,将恒定流速的灌注液泵入内部管道,体内的神经递质等溶质在浓度差的驱动下被动扩散到探针中,并在动物/人体外的出口管(透析液)的末端取样(如图1)。
如果灌注液中的浓度高于细胞外液中的浓度,则溶质从灌注液反向进入细胞间隙,这通常在反透析校准方法中使用。
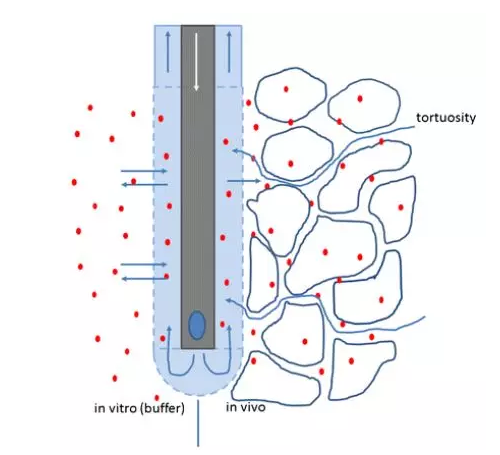
(图1)
图1:分子在体外和体内穿过半透性微透析探针膜运动。灌注液是从内部金属杆通过孔流出(蓝色椭圆形),然后沿着膜反向流出并在体外收集透析液。在缓冲溶液中,分子可以自由移动,组织中由于细胞的存在,出现曲折性,分子需要更长的路径才能到达探针。
微透析发展历程
从1985年到1995年的10年间,微透析的文章数量从每年2篇爆发到每年600多篇,原因是该方法可以研究体内局部大脑区域的神经递质释放干预措施。
微透析出版物的数量在20世纪90年代末至21世纪初期以每年700-800种出版物的增幅出现高峰,此后平均每年出版约400-500种出版物。
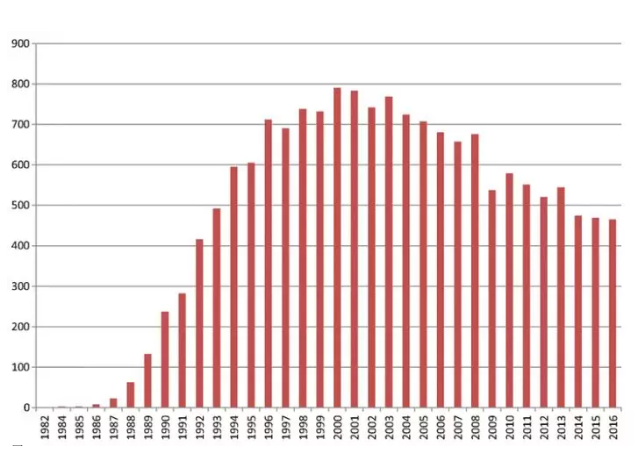
根据PubMed的信息,每年关于“微透析”的出版物数量如图,其中71%是脑微透析研究,24%是人类的微透析研究。
传统的微透析方法多采用微透析探针进行脑内神经递质的监测。但有限的时间分辨率、空间分辨率、膜孔径等因素,限制了微透析广泛的应用,但微透析应用不止于此。随着几十年的发展,一些实验室对微透析技术进行了深入的探索。这使得微透析具有更广泛的应用前景。
以下,介绍4种微透析改进方法及延伸应用方向。
一:大分子微透析
微透析的一个特殊优点是能够检测细胞间隙难以被常规传感器处检测到的大分子(肽和蛋白质)。肽类(如神经肽)和信号分子(如细胞因子),存在浓度低,使得收集和分析变得困难。
微透析探针的孔径决定了可穿透膜的分子大小,更大截留分子量的膜允许蛋白质、肽类等大分子穿过。但半透膜孔径越大,灌流液越容易通过膜渗入细胞间隙,导致探针处组织水肿。
为避免这种情况发生,通常会在探针输出管路使用蠕动泵同步进行抽取。Eicom在很早之前就推出了一款大分子透析探针AtmosLM™,压力消除微透析探针(图2)。
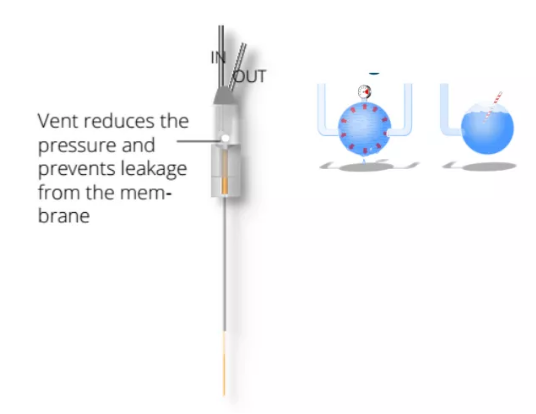
(图2)
图2:AtmosLM探针的膜为1,000,000 Da MWCO(截留分子量),允许大分子通过。探针内的排气口防止探头内的压力超过大气压,防止流体在膜处泄漏。越来越多的蛋白质被成功地检测出来。包括:TNF-a、淀粉样蛋白b、IL-6、Tau、BDNF和CRF。
注:灌注液中加入抗体或其他亲和剂可以增加浓度差和回收率。该方法可以使神经肽和细胞因子的收集率提高几倍。
二:高时间分辨率
微透析的时间分辨率受到分析方法的灵敏度限制。因为每个馏分必须收集足够的样品才能够用来检测目标化合物。高灵敏度的方法,如毛细管电泳和激光诱导荧光检测,可以测定每隔几秒收集的馏分,显著提高了使用GX液相(HPLC)进行分析的时间分辨率。
毛细管电泳(CE)分离的高速度也使其与通过以秒间隔收集的大量馏分相兼容。使用这些方法发现,当一段时间收集的馏分从探针运输到分析系统时,会与管路中两端的液体产生相互扩散,时间分辨率因此受到限制。
虽然这种扩散可以通过使用短管路来限制,但这种方法对于自由移动动物的实验是不切实际的。此问题已通过由不混溶流体(氟化油)分割透析探针流出的液体解决(图3)。
使用微流体T形进行分割,所述微流体T形可以安装在动物的头部上以产生纳升体积分数收集器。分段样品不会通过流动或扩散混合,因此无论所需的连接管长度如何,都可以将时间信息保持几秒钟。
这种方式极高的提高了微透析的时间分辨率。因此,可以与高时间分辨率的光遗传、电生理等技术手段更有效结合。
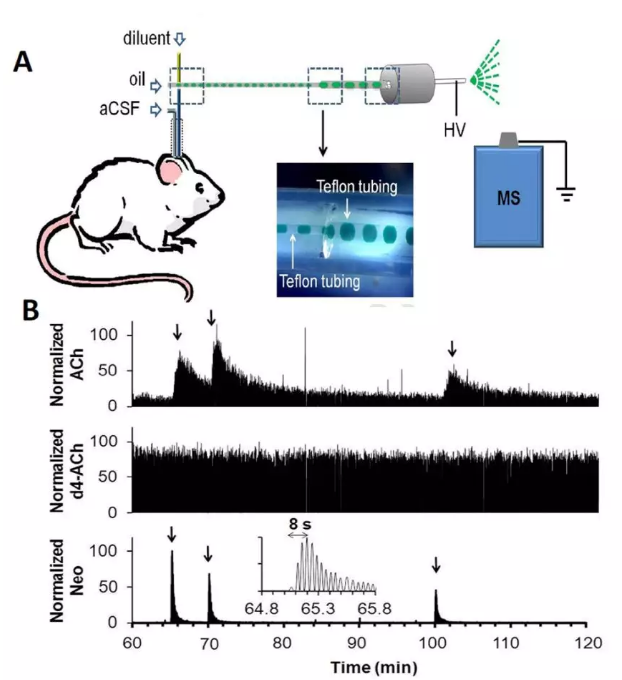
(图3)
图3:(A)将探针出口端透析液泵入安装在受试者头部的交叉流体结构中。在十字架中,将氟化油和内标溶液泵入单独的入口中。产生的分段流从第四接口出现并被泵送到质谱仪(MS)。(B)将探针插入大鼠纹状体,用A系统记录新斯的明体内微注射反应。该图显示了同时检测乙酰胆碱(ACh),内标,d4-乙酰胆碱(d4-ACh)和新斯的明(Neo)的样品痕量。通过质谱仪以特定的m / z记录每种化合物。箭头表示每次显微注射的开始。插入图是diyi次微注射新斯的明的放大图,显示了单个液滴的探测和快速响应时间。
注:Microchip电泳(氨基酸),酶测定(谷氨酸),电化学和直接输注质谱(乙酰胆碱)已经与分段流动系统结合以产生以几秒间隔收集的样品的高通量测定。虽然大部分液滴工作都是通过在线检测完成的,但收集和储存液滴以供以后分析也是可行的。
三:高空间分辨率
微透析探针的直径通常为200至400μm,采样长度为1-4mm。这个大小限制了从较小的大脑区域采样的可能性。可以制造更小的探针(例如,长0.5毫米,直径200微米),如果使用的分析方法足够灵敏,可以成功使用。更激进的方法是使用低流速推拉灌注(图4)。
在该方法中,取样发生在两个紧密间隔的毛细管的处。一种流体取出样品(“拉”),同时从另一毛细管泵送补充流体(“推动”)以维持取样区域中的流体平衡。采样发生在,因此空间分辨率得到提高。
使用50nL / min或更低的流速来Z小化流体与组织直接接触的潜在破坏作用,这些探针的局限性是时间分辨率差。考虑到在50 nL / min时,可能需要20分钟才能收集1μL进行分析。直接偶联毛细管电泳可以缓解这种担忧。
该方法与分段流相结合,便可以获得高时间分辨率和空间分辨率。体外结果表明亚秒采样是可能的,创造了将采样方法(广泛选择的分析方法)与传感器(高空间和时间分辨率)相结合的令人兴奋的前景。

(图4)
图4:比较不同采样探针的大小。Z上的探针是常规微透析取样探针。白色材料是取样膜。“Mini”是一种可以手动制造的小型微透析探针。采样区域是的清晰区域(长约0.5毫米,直径0.2毫米)。“Push-pull”是两个熔融石英毛细管,涂有聚酰亚胺,与环氧树脂熔合在一起,采样发生在。“Microfabpush-pull”是一种基于Si的探针,由光刻和体蚀刻技术制成。沿着柄部和,探针宽度为85微米,厚度为70微米。采样发生在直径为20微米的孔口。
注:虽然这种方法仍处于早期发展阶段,但Z初的应用已经展现突出的空间分辨率。例如,该方法与LC-MS结合使用,即使在极小的脑区(如腹侧被盖区域)内也能显示几种神经递质的基础浓度急剧下降。
四:多技术结合
随着多种实验技术的成熟,越来越多的研究者将不同的实验技术结合到同一个研究课题中。微透析技术同样具有良好的兼容性,可以与多种实验技术联合使用,如:
·多探针联合研究
·微量注射与微透析联合

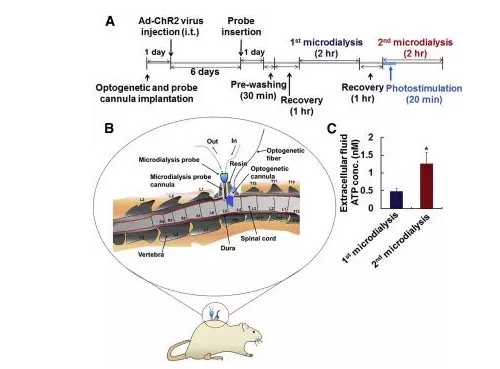
·微透析与光遗传结合
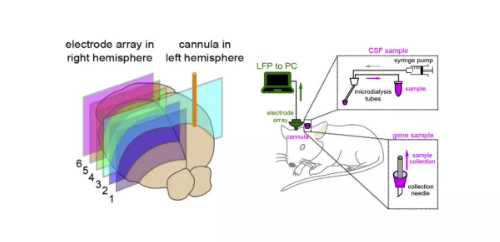
·微透析与电生理结合
·微透析与行为学结合

(瑞沃德微透析HPLC-ECD整套解决方案)
参考文献:
1.Kennedy R T. Emerging trends in in vivo neurochemical monitoring by microdialysis[J]. Current opinion in chemical biology, 2013, 17(5): 860-867.
2.Hammarlund-Udenaes M. Microdialysis as an important technique in systems pharmacology—a historical and methodological review[J]. The AAPS journal, 2017, 19(5): 1294-1303
3.Chen C, Nakagawa S, Kitaichi Y, et al. The role of medial prefrontal corticosterone and dopamine in the antidepressant-like effect of exercise[J]. Psychoneuroendocrinology, 2016, 69: 1-9.
4.Zestos A G, Luna-Munguia H, Stacey W C, et al. Use and Future Prospects of in Vivo Microdialysis for Epilepsy Studies[J]. ACS chemical neuroscience, 2018, 10(4): 1875-1883.
5.Nam Y, Kim J H, Kim J H, et al. Reversible induction of pain hypersensitivity following optogenetic stimulation of spinal astrocytes[J]. Cell reports, 2016, 17(11): 3049-3061.
6.Konno D, Nakayama R, Tsunoda M, et al. Collection of biochemical samples with brain-wide electrophysiological recordings from a freely moving rodent[J]. Journal of pharmacological sciences, 2019, 139(4): 346-351.
7.Chen C, Nakagawa S, Kitaichi Y, et al. The role of medial prefrontal corticosterone and dopamine in the antidepressant-like effect of exercise[J]. Psychoneuroendocrinology, 2016, 69: 1-9.
 应对环境挑战 | 选择:不止一种
应对环境挑战 | 选择:不止一种

 评论
评论