大部分化疗药物如铂类药物等,都是通过破坏肿瘤细胞中的DNA来YZ细胞的生长,从而达到治LX果。然而,“聪明”的肿瘤可以采用另一种替代性的DNA跨损伤合成(translesion synthesis,TLS)途径来完成复制并获得耐药性。针对TLS的靶向化ZL是非常有前景的开发方案。
来自麻省理工学院和杜克大学的研究人员发现一种可阻断TLS途径的小分子化合物并发表在CELL上。同时,用这种化合物和顺铂联合ZL体外肿瘤细胞和荷瘤小鼠时,都有显著的效果。
这样有临床应用潜力的明星分子是如何被发现的呢?
在哺乳动物细胞中,TLS的发生包括两个步骤,首先插入TLS DNA聚合酶,如POL kPOL i、POL h或REV1,在损伤处引入一个核苷酸;接下来是募集b族聚合酶复合物POL z (POL z4: REV3L/REV7/POLD2/POLD3)进行3’端的延伸。而其中起主要作用的是约100个氨基酸的REV1 C-terminal domain (CTD),它可以招募插入TLS的其他聚合酶POL k、POL i和POL h,并通过与REV7的相互作用来招募POL z。
基于此,作者首先分别构建了His8-tagged REV7/3和FLAG-tagged POL k RIR-REV1 CTD表达系统并对融合蛋白进行纯化,然后基于ELISA方法对化合物库中高达~10000种化合物进行筛选,并将目标锁定了JH-RE-06。
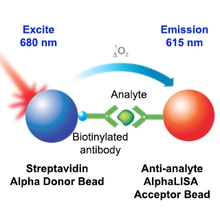
然后作者采用高灵敏定量AlphaScreen技术,通过抗FLAG供体微珠、抗His受体微珠构建匀相反应体系,进一步确定了化合物JH-RE-06对REV1-REV7的阻断作用,并得出了其IC50值为0.78 mM。

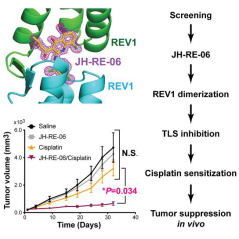
随后,作者在分别在多种人类癌细胞和人类黑色素瘤小鼠模型上进行了验证,证实此化合物可以提高癌细胞对顺铂类化合物的敏感性和长期化疗的有效性,并对其他以DNA为作用靶标的类似药物,都有同样的类似效果。
作者用清晰的思路论述了筛选和验证化合物的过程,并进一步讨论了化合物耐药性机制:JH-RE-06能与Rev1结合并生成二聚体,而一旦形成这样的二聚体结构,则不能与Rev3 / Rev7 TLS DNA聚合酶结合,直接阻止了TLS的发生和癌细胞的快速复制,同时,也更进一步制止了突变产生的可能性,避免了癌细胞获得耐药性。
在整个实验过程中,采用ALPHA技术对初筛得到的化合物JH-RE-06的功能验证是非常重要的一步:
ALPHA的方法采用单体氧作为能量扩散的载体,其扩散距离可以达到200nm,发光原理为化学反应发光,具有背景干净、信噪比高的特点,同样适合于复杂样品的检测,如组织液、血清、组织裂解液等,步骤少、方法简单、均相反应、不需要洗涤,因此实验结果质量更高。同时推荐选择具有HTS ALPHA检测模块的多功能酶标仪进行抗体的筛选,可以大大缩短检测时间。
参考文献
Jessica L. Wojtaszek, Nimrat Chatterjee, et al. ;(2019).A Small Molecule Targeting Mutagenic Translesion Synthesis Improves Chemotherapy. Cell. 178, 1–8,June 27
 网络研讨会预告 | 分子库药物筛选助力快速发现抗新冠病物
网络研讨会预告 | 分子库药物筛选助力快速发现抗新冠病物

 评论
评论