6月25日,在太平洋彼岸,由Nature主办珀金埃尔默协办的网络直播中,多伦多大学的David Andrews博
士[1] 和来自悉尼大学的Elizabeth New博士[2] 结合珀金埃尔默解决方案,向我们展示单细胞水平分析推动下的前沿癌症研究。大家可以在微信文末获得完整视频的链接,同时我们特意做了视频的汉化,并提供双语字幕,让大家的学习更加轻松有效。

高内涵应用的临床转化
David Andrews博士关注高内涵应用的临床转化,致力于利用病人来源的肿瘤细胞(Patient-derived cell,PDC)模型实现肿瘤ZL的精 准YL。在该研究中,Opera Phenix 高内涵平台在20X物镜配置下(临床转化考量),主导基于1536孔板的高通量细胞表型筛选。


基于体外模型进行药效预测的一大挑战就是在支持高通量筛选的同时,如何保证样本的病理生理相关性。针对血液瘤样本,David Andrews利用小分子化合物模拟体内微环境,在不过度改变细胞命运的情况下对PDC进行一定的重编程。并在此基础上,David Andrews通过多种染料分析了常见的细胞活力指标,包括细胞核形态、线粒体膜电位和凋亡等。

在单细胞解析中,David Andrews向我们强调了样本的复杂性,需要利用机器自学习的优势来深度挖掘药物处理后的表型变化。利用对照药物,研究通过多指标分析定义多种表型,并以此为基础进行临床抗肿瘤药物的药效预测。通过分析药物处理后的PDC细胞表型,不仅能预测针对特定病人的药物ZL有效性,还能挖掘药物对应的细胞表型,做到了细胞表型-药物相互作用的深度分析。


Z 后的答疑环节也非常精彩,涉及到流式细胞技术、免疫ZL、外泌体、临床转化和机器自学习等多个热门方向。在答疑的过程中,David Andrews也强调了Opera Phenix 高内涵平台的Pre-scan和水镜等优势,是能灵活用于从科研研究到临床应用开发的检测平台。
单细胞ICP-MS应用优势
Elizabeth New博士则从金属药物和纳米材料分析角度出发,展示了单细胞水平分析在肿瘤药物研究中的应用前景。现阶段,铂类等金属药物已经成为化疗ZL中的一线用药,并且是多种联合用药的基础。要了解金属药物和细胞之间的相互作用,我们离不开分析细胞对金属的摄取和积累,探究药物和蛋白&DNA之间的相互作用,以及药物处理对整个细胞稳态的影响。传统的分析技术主要基于大量细胞的裂解液得出均一化的结果,因此受到金属药物代谢多样性和肿瘤细胞异质性的挑战。


针对金属药物代谢多样性的难题,Elizabeth New利用荧光探针特异识别具有活性的铂类药物代谢中间体,并结合成像技术分析肿瘤细胞对药物的摄取情况。类似地,基于流式技术的分析方法也可以从单细胞水平分析细胞的的氧化还原状态。
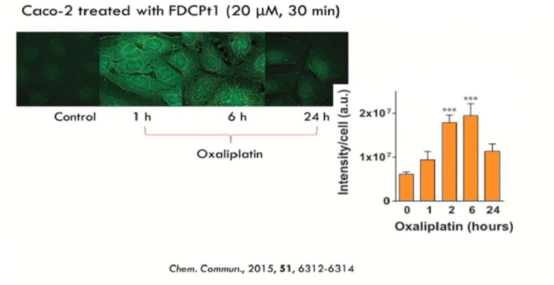
众所周知,精 准医学需要解决的一大难题就是肿瘤异质性分析。结合了电感耦合等离子体(ICP)的高温电离特性的质谱技术(ICP-MS)虽然极为灵敏,但无法从单细胞水平解析肿瘤细胞的异质性。因此,单细胞ICP-MS分析技术因运而生。在拥有质谱灵敏度的同时,珀金埃尔默的单细胞ICP-MS解决方案仅需少量的细胞,就可完成多种细胞的胞内金属离子的特异检测。这次报告中,Elizabeth New从金属含量和纳米颗粒分析两个方向展示了单细胞ICP-MS的应用优势。

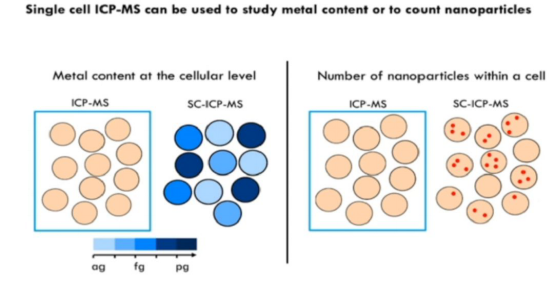
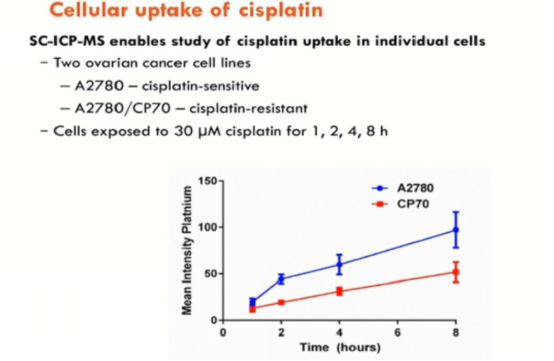
基于单细胞ICP-MS分析的结果,我们可以看到随着时间的推移,肿瘤细胞逐渐积累金属药物。同时对比顺铂敏感的肿瘤细胞株,耐受细胞株明显摄取更少的金属药物。进一步的实验证明,血清饥饿导致的细胞周期变化不会影响细胞对药物的摄取。针对纳米金的研究,ICP-MS可直接用于分析悬液样本中的颗粒大小和均一性等理化性质,而单细胞ICP-MS则能从单细胞水平发现肿瘤细胞对纳米金颗粒摄取的异质性。

扫描下方二维码,
获取完整视频。

参考文献
1.https://sunnybrook.ca/research/team/member.asp?m=514&page=172
2.https://sydney.edu.au/science/people/elizabeth.new.php
关于珀金埃尔默:
珀金埃尔默致力于为创建更健康的世界而持续创新。我们为诊断、生命科学、食品及应用市场推出独特的解决方案,助力科学家、研究人员和临床医生解决Z棘手的科学和YL难题。凭借深厚的市场了解和技术专长,我们助力客户更早地获得更准确的洞见。在,我们拥有12500名专业技术人员,服务于150多个国家,时刻专注于帮助客户打造更健康的家庭,改善人类生活质量。2018年,珀金埃尔默年营收达到约28亿美元,为标准普尔500指数中的一员,纽交所上市代号1-877-PKI-NYSE。
了解更多有关珀金埃尔默的信息,请访问www.perkinelmer.com.cn。
 单细胞纳米注射网络研讨会
单细胞纳米注射网络研讨会
 为什么珀金埃尔默单细胞 (Single Cell)-ICP-MS技术如此独特
为什么珀金埃尔默单细胞 (Single Cell)-ICP-MS技术如此独特

 评论
评论