-

-
斑马鱼呼吸代谢测量解决方案
- 品牌:丹麦loligo
- 型号: loligo
- 产地:欧洲 其它
- 供应商报价:面议
-
北京易科泰生态技术有限公司
 更新时间:2025-04-10 09:41:22
更新时间:2025-04-10 09:41:22 -
销售范围售全国
入驻年限第10年
营业执照已审核
- 同类产品水生动物呼吸与能量代谢(9件)

立即扫码咨询
联系方式:13466520071
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
扫 码 分 享 -
为您推荐
- 1
- 2
- 3
详细介绍
斑马鱼呼吸代谢测量解决方案
斑马鱼呼吸代谢测量解决方案包括斑马鱼在不同生长阶段(胚胎、幼鱼、成鱼)和不同活动状态(静态和游泳状态)下的多种呼吸代谢测量系统。解决方案均基于光纤氧传感器技术,可测定斑马鱼、鳉鱼、青鳉、刺鱼等小型鱼类的氧气消耗,评估其能量代谢水平,广泛用于生态毒理学、生物医学、动物发育、水产养殖等研究领域。

配置组成
系统名称
测量方式
功能特点
测量参数
斑马鱼成鱼呼吸代谢测量标准系统
间歇式
4、8、12、16、20通道可选
全自动测量
实时耗氧率测定和分析
深入的数据分析、统计和输出
耗氧率(MO2/VO2)
标准代谢率SMR
Q10温度系数
Pcrit临界氧气分压
斑马鱼成鱼呼吸代谢测量定制系统
间歇式
单通道、多通道可选
全自动测量
高性价比
耗氧率(MO2/VO2)
标准代谢率SMR
斑马鱼胚胎、幼鱼高通量测量系统
封闭式
24240通道高通量分析
实时耗氧率测定和分析
耗氧曲线
耗氧率(MO2/VO2)
斑马鱼游泳呼吸仪
间歇式
1-10通道可选
全自动测量
实时耗氧率测定和分析
深入的数据分析、统计和输出
标准代谢率SMR
max代谢率MMR
有氧代谢范围AS
Ucrit临界游泳速度
单位距离能耗COT
……
功能特点
l 斑马鱼成鱼采用“间歇式”呼吸测量法,集合了“开放式”呼吸测量法测量时间长和“封闭式”呼吸测量法简易的优点,同时克服了“开放式”时间解析度差、“封闭式”不能连续长时间测量的缺点
l 溶解氧测量采用荧光光纤氧气测量技术,测量精度高、稳定性强、无氧耗
l 可根据所需参数、斑马鱼生长阶段、通道数等方面选择合适的系统
l 自动化控制、记录及分析数据,简单易用
l 可选斑马鱼高通量视频跟踪及行为分析系统,同时对24孔、48孔、96孔板中的斑马鱼进行高通量行为采集和分析
技术指标
1. 斑马鱼成鱼呼吸代谢测量标准系统
Ø 荧光光纤氧气测量系统:包括四通道测量主机、粘贴式氧气传感器及温度传感器等,采用蓝牙通讯,可长期稳定在线监测水体和空气中的氧气。
a. 氧气测量范围:0 - 475%空气饱和度
b. 检测极限:±0.15%空气饱和度
c. 精度:±0.5%空气饱和度
d. 温度精度:±0.15℃
e. 温度、盐度、气压实时补偿
f. 不受电磁信号干扰
Ø 自动控制及分析软件:快速启动间歇式呼吸测量,自动化控制实验,包括实时的数据获取、传感器校准、硬件控制、水环境调节和数据后处理、统计、导出。
a. 5种以上呼吸测量模式:封闭、开放、间歇式(时间)、间歇式(氧气水平)、间歇式(相关系数)
b. 可测量分析参数:耗氧率(MO2/VO2)、标准代谢率(SMR)、温度系数Q10、临界氧气分压(Pcrit)等
c. 具备“相位表”功能,可实时显示每个通道的状态、跟踪多通道实验的进程。
d. 可跨多个实验进行数据分析和统计,可设定和管理处理组并对不同处理组或者实验进行数据比较和统计
Ø 玻璃呼吸室:包含丙烯酸水浴箱、硼硅酸玻璃呼吸室及适配环、呼吸室支架、小型直流泵及电源适配器等,呼吸室内径9mm、14.5mm、18.5mm、28mm可选,每个内径三种长度可选;直流泵5V-12V可调,流量50 - 1500 ml/min


2. 斑马鱼成鱼呼吸代谢测量定制系统
Ø 荧光光纤氧气测量系统:包括溶解氧测量主机、流通管氧气传感器及温度传感器等,可长期稳定在线监测水体和空气中的氧气。
a. 主机单通道、双通道、四通道光学传感器可选,具备独立Pt100热电阻温度传感器通
 道
道b. 采样频率:max每秒10-20次
c. 主机内置气压、湿度传感器
d. 测量范围:0 - 500 %空气饱和度
e. 精度:1% @95%空气饱和度
Ø 自动采集及分析软件:可支持多达10个测量设备同时运行,提供设备设置、传感器校准、数据记录及分析等功能。
Ø 呼吸室:包括丙烯酸材质呼吸室、小型潜水泵及定时装置、管路、调节阀等。
3. 斑马鱼胚胎、幼鱼高通量测量系统
Ø 高通量测量系统:包括24孔板及其读取器、密封及固定装置等,多个读取器可串联组成240个通道。
a. 氧气量程:0 - 235 %空气饱和度
b. 分辨率:±2%空气饱和度
c. 精度:±5%空气饱和度
d. 漂移:<1%空气饱和度(一周内,10min采集间隔)
e. 24孔板硼硅酸玻璃材质,80-1700μL可选
Ø 自动采集和分析软件:集设备通讯、校准、数据获取、分析统计于一体,采样率小于5s,可对每个传感器独立进行两点校准,实时计算耗氧率,可保存数据、图表,输出Excel数据文件。

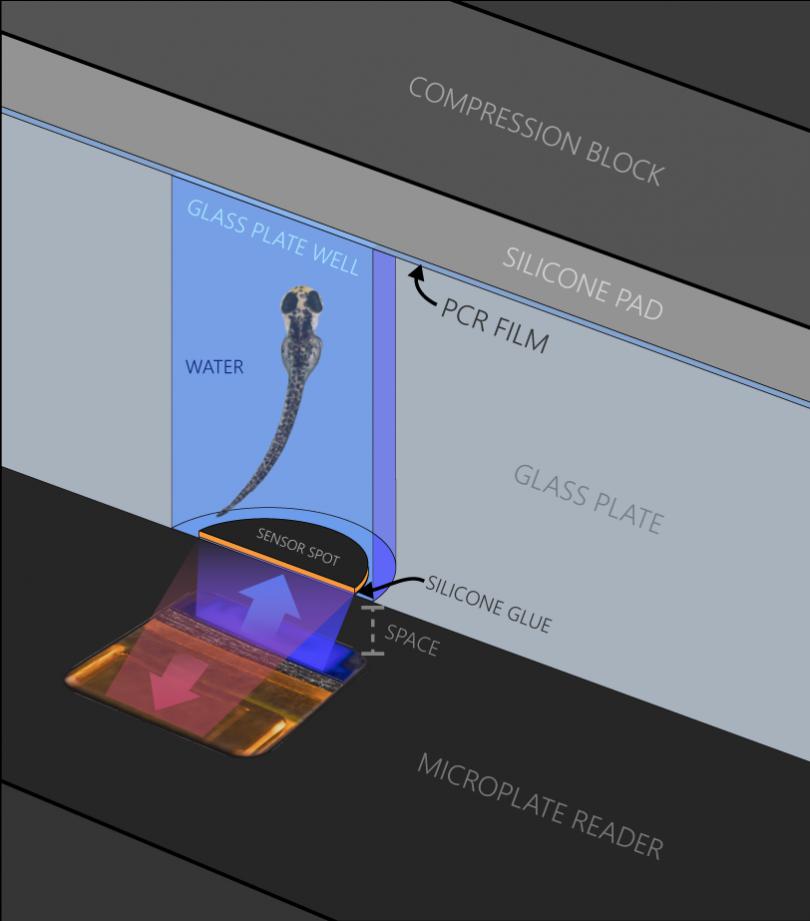
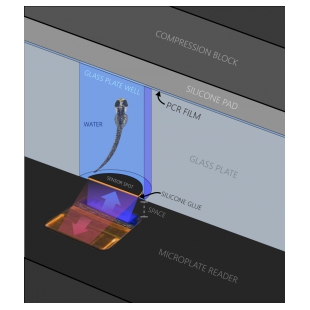
4. 斑马鱼游泳呼吸仪
Ø 斑马鱼游泳仪:包括水浴箱、呼吸室、潜水泵及管路、电机及控制盒、蓝牙控制装置等,170mL和1500mL两种规格可选。170mL游泳仪适用于小于4g的鱼,可提供0.7 - 50cm/s的流速;1500mL游泳仪适用于4 - 12g鱼,流速为3 - 100cm/s。潜水泵5L/min。
Ø 溶解氧测量装置:包括单通道溶解氧测量仪、探头式氧气传感器及Pt1000温度传感器。
a. 氧气测量范围:0 - 475%空气饱和度
b. 检测极限:±0.15%空气饱和度
c. 精度:±0.5%空气饱和度
d. 温度精度:±0.15℃
e. 温度、盐度、气压实时补偿
f. 不受电磁信号干扰
Ø 流速校准单元:基于DPTV(微粒视频跟踪速度测量法)包括自动流速测量及校准软件、绿色荧光聚乙烯微球、绿色激光笔、工业相机及镜头等硬件。
Ø 自动控制及分析软件:快速启动间歇式呼吸测量,自动化控制实验,包括实时的数据获取、传感器校准、硬件控制、水环境调节和数据后处理、统计、导出。
e. 5种以上呼吸测量模式:封闭、开放、间歇式(时间)、间歇式(氧气水平)、间歇式(相关系数)
f. 可测量分析参数:耗氧率(MO2/VO2)、标准代谢率(SMR)、温度系数Q10、临界氧气分压(Pcrit)、max代谢率(MMR)、有氧代谢范围(AS)、临界游泳速度(Ucrit)、单位距离能耗(COT)等
g. 具备“相位表”功能,可实时显示每个通道的状态、跟踪多通道实验的进程。
h. 可跨多个实验进行数据分析和统计,可设定和管理处理组并对不同处理组或者实验进行数据比较和统计

应用案例
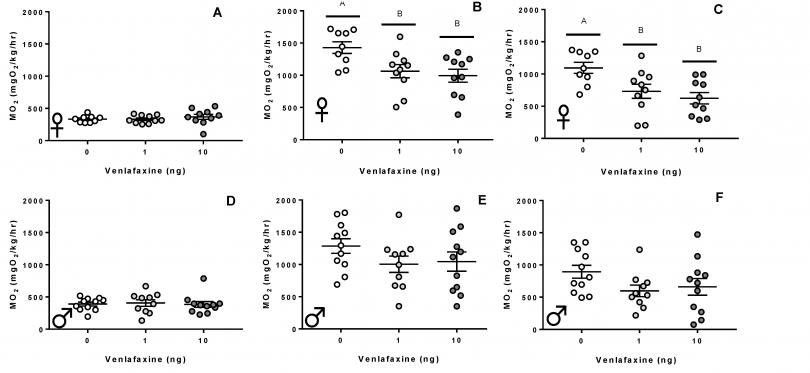
1. 斑马鱼成鱼呼吸代谢测量标准系统被用于测定不同剂量抗抑郁药文拉法辛(Venlafaxine)早期(1-4细胞时期)暴露对斑马鱼成鱼标准代谢率(A、D)、活动代谢率(B、E)、有氧代谢范围(C、F)和雌性(A-C)、雄性(D-F)的影响,发现其存在性别特异性:文拉法辛早期暴露仅使雌性斑马鱼的活动代谢率和有氧代谢范围显著降低(Biology, 2022)。
2. 斑马鱼胚胎、幼鱼高通量测量系统被用于测定6PPD(轮胎抗氧化剂)及6PPD醌对斑马鱼幼鱼耗氧率的影响,发现暴露在PPD(A)及其醌(B)96h的斑马鱼幼鱼氧气消耗相比于对照组有所升高,并存在剂量和时间依赖性(Journal of Hazardous Materials, 2022)。


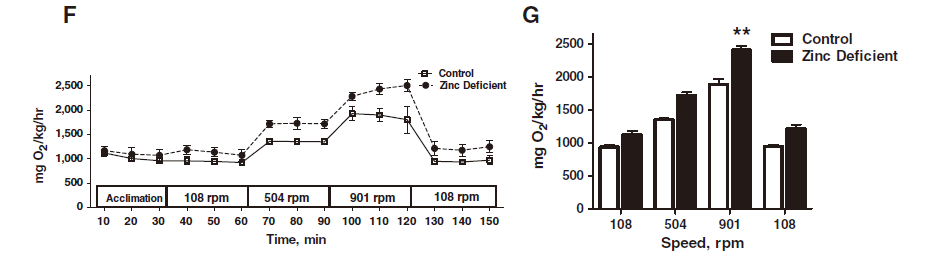
3. 斑马鱼游泳呼吸仪用来测定不同水流速度下的对照组斑马鱼和缺锌斑马鱼的氧气消耗率,以评估其身体适应力(physical fitness),发现随着水流速度的提升,缺锌斑马鱼游动更剧烈,导致其耗氧率显著升高,身体适应度降低(The Journal of Nutritional Biochemistry, 2017)。
参考文献
1. Beaver, L. M., Nkrumah-Elie, Y. M., Truong, L., Barton, C. L., Knecht, A. L., Gonnerman, G. D., Wong, C. P., Tanguay, R. L., & Ho, E. (2017). Adverse effects of parental zinc deficiency on metal homeostasis and embryonic development in a zebrafish model. The Journal of Nutritional Biochemistry, 43, 78–87.
2. Braz-Mota, S., Campos, D. F., MacCormack, T. J., Duarte, R. M., Val, A. L., & Almeida-Val, V. M. F. (2018). Mechanisms of toxic action of copper and copper nanoparticles in two Amazon fish species: Dwarf cichlid (Apistogramma agassizii) and cardinal tetra (Paracheirodon axelrodi). Science of The Total Environment, 630, 1168–1180.
3. Ferreira, M. S., Wood, C. M., Harter, T. S., Dal Pont, G., Val, A. L., & Matthews, P. G. D. (2019). Metabolic fuel use after feeding in the zebrafish (Danio rerio): A respirometric analysis. The Journal of Experimental Biology, 222(Pt 4), jeb194217.
4. Folkerts, E. J., Blewett, T. A., He, Y., & Goss, G. G. (2017). Cardio-respirometry disruption in zebrafish (Danio rerio) embryos exposed to hydraulic fracturing flowback and produced water. Environmental Pollution, 231, 1477–1487.
5. Mandic, M., Best, C., & Perry, S. F. (2020). Loss of hypoxia-inducible factor 1α affects hypoxia tolerance in larval and adult zebrafish (Danio rerio). Proceedings of the Royal Society B: Biological Sciences, 287(1927), 20200798.
6. Park, K.-H., Ye, Z., Zhang, J., Hammad, S. M., Townsend, D. M., Rockey, D. C., & Kim, S.-H. (2019). 3-ketodihydrosphingosine reductase mutation induces steatosis and hepatic injury in zebrafish. Scientific Reports, 9(1), 1138.
7. Polverino, G., Bierbach, D., Killen, S. S., Uusi-Heikkilä, S., & Arlinghaus, R. (2016). Body length rather than routine metabolic rate and body condition correlates with activity and risk-taking in juvenile zebrafish Danio rerio. Journal of Fish Biology, 89(5), 2251–2267.
8. Thomas, J. K., & Janz, D. M. (2015). Developmental and Persistent Toxicities of Maternally Deposited Selenomethionine in Zebrafish (Danio rerio). Environmental Science & Technology, 49(16), 10182–10189.
9. Thompson, W. A., Shvartsburd, Z., & Vijayan, M. M. (2022). Sex-Specific and Long-Term Impacts of Early-Life Venlafaxine Exposure in Zebrafish. Biology, 11(2), Article 2.
10. Varshney, S., Gora, A. H., Siriyappagouder, P., Kiron, V., & Olsvik, P. A. (2022). Toxicological effects of 6PPD and 6PPD quinone in zebrafish larvae. Journal of Hazardous Materials, 424, 127623.
解决方案