电位滴定法(potentiometric titration)是在滴定过程中通过测量电位变化以确定滴定终点的方法,和直接电位法相比,电位滴定法不需要准确的测量电极电位值,因此,温度、液体接界电位的影响并不重要,其准确度优于直接电位法,普通滴定法是依靠指示剂颜色变化来指示滴定终点,如果待测溶液有颜色或浑浊时,终点的指示就比较困难,或者根本找不到合适的指示剂。电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定到达终点前后,滴液中的待测离子浓度往往连续变化n个数量级,引起电位的突跃,被测成分的含量仍然通过消耗滴定剂的量来计算。
使用不同的指示电极,电位滴定法可以进行酸碱滴定,氧化还原滴定,配合滴定和沉淀滴定。酸碱滴定时使用PH玻璃电极为指示电极,在氧化还原滴定中,可以从铂电极作指示电极。在配合滴定中,若用EDTA作滴定剂,可以用汞电极作指示电极,在沉淀滴定中,若用硝酸银滴定卤素离子,可以用银电极作指示电极。在滴定过程中,随着滴定剂的不断加入,电极电位E不断发生变化,电极电位发生突跃时,说明滴定到达终点。用微分曲线比普通滴定曲线更容易确定滴定终点。
如果使用自动电位滴定仪,在滴定过程中可以自动绘出滴定曲线,自动找出滴定终点,自动给出体积,滴定快捷方便。
进行电位滴定时,被测溶液中插入一个参比电极,一个指示电极组成工作电池。随着滴定剂的加入,由于发生化学反应,被测离子浓度不断变化,指示电极的电位也相应地变化。在等当点附近发生电位的突跃。因此测量工作电池电动势的变化,可确定滴定终点。
包括滴定管、滴定池、指示电极、参比电极
电位滴定法比起用指示剂的容量分析法有许多优越的地方,首先可用于有色或混浊电位滴定曲线的溶液的滴定,使用指示剂是不行的;在没有或缺乏指示剂的情况下,用此法解决;还可用于浓度较稀的试液或滴定反应进行不够完全的情况;灵敏度和准确度高,并可实现自动化和连续测定。因此用途十分广泛。
按照滴定反应的类型,电位滴定可用于中和滴定(酸碱滴定)沉淀滴定,络合滴定,氧化还原滴定。
一般酸碱滴定都可以采用电位滴定法;特别适合于弱酸(碱)的滴定;可在非水溶液中滴定极弱酸;
指示电极:玻璃电极,锑电极;
参比电极:甘汞电极;
(1) 在醋酸介质中用HClO₄滴定吡啶;
(2) 在乙醇介质中用 HCl 溶液滴定三乙醇胺
(3) 在异丙醇和乙二醇混合溶液中HCl 溶液滴定苯胺和生物碱;
(4) 在二甲基甲酰胺介质中可滴定苯酚;
(5) 在丙酮介质中可以滴定高氯酸、盐酸、水杨酸混合物。
参比电极:双盐桥甘汞电极;甘汞电极
(1)指示电极:银电极
标准溶液:AgNO₃;
滴定对象:Clˉ、Brˉ、Iˉ、CNSˉ、Sˉ²、CNˉ等。
可连续滴定 Clˉ、Brˉ、Iˉ;
(2) 指示电极:汞电
标准溶液:硝酸gong;
滴定对象:Clˉ、Brˉ、Iˉ、CNSˉ、Sˉ²、C₂O₄ˉ²等。
(2)指示电极:铂电极
标准溶液:K₄[Fe(CN)6;
滴定对象:Pd²﹢、Cd²﹢、Zn²﹢、Ba²﹢ 等。
参比电极:甘汞电极;
指示电极:铂电极;
(1)标准溶液:高锰酸钾;
滴定对象:Iˉ、NO₃ˉ、Fe²﹢、V⁴﹢、Sn²﹢、 C₂O₄²ˉ。
(2)标准溶液: K₄[Fe(CN)6;
滴定对象:Co²﹢ 。
(3)标准溶液: K₂Cr₂O7;
滴定对象: Fe²﹢ 、 Sn²﹢、 Iˉ、Sb³﹢ 等。
参比电极:甘汞电极;
标准溶液:EDTA
(1)指示电极:汞电极;
滴定对象:Cu²+ 、Zn²+、 Ca²+ 、 Mg²+、Al³+ 。
(2)指示电极:氯电极;
用氟化物滴定Al³+ 。
(3)指示电极:钙离子选择性电极;
滴定对象: Ca²+ 等。
 电位滴定仪常见故障维修
电位滴定仪常见故障维修
 电位滴定仪的使用方法及注意事项
电位滴定仪的使用方法及注意事项
 食品油脂的酸价测定方法和步骤
食品油脂的酸价测定方法和步骤
 电位滴定法
电位滴定法
 电位滴定仪原理
电位滴定仪原理
 瑞士万通 Eco 自动电位滴定仪
瑞士万通 Eco 自动电位滴定仪


 瑞士万通905 爱•智能系列全自动电位滴定仪
瑞士万通905 爱•智能系列全自动电位滴定仪


 瑞士万通OMNIS奥秘一代全新电位滴定平台
瑞士万通OMNIS奥秘一代全新电位滴定平台


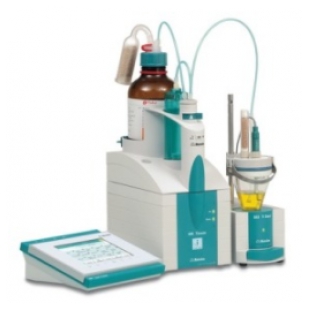 瑞士万通906爱• 智能系列全自动电位滴定仪
瑞士万通906爱• 智能系列全自动电位滴定仪


 瑞士万通OMNIS奥秘一代全新电位滴定平台
瑞士万通OMNIS奥秘一代全新电位滴定平台


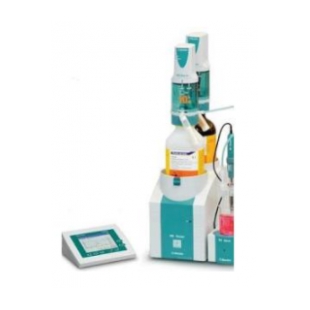 905/907 爱•智能 系列全自动电位滴定仪
905/907 爱•智能 系列全自动电位滴定仪


 904/906 爱•智能 系列全自动电位滴定仪
904/906 爱•智能 系列全自动电位滴定仪


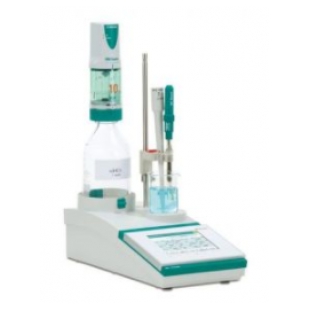 瑞士万通916 Ti-Touch 精灵一代 一体式电位滴定仪
瑞士万通916 Ti-Touch 精灵一代 一体式电位滴定仪


 888专业型Titrando智能电位滴定仪
888专业型Titrando智能电位滴定仪


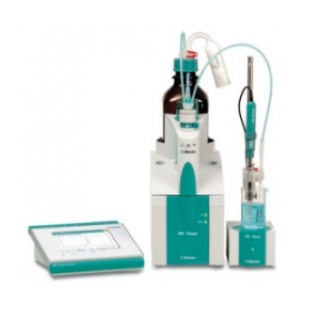 瑞士万通904爱•智能系列全自动电位滴定仪
瑞士万通904爱•智能系列全自动电位滴定仪


 加载中...
加载中...
已显示全部信息