
立即扫码咨询
联系方式:010-65528800
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
一、背景:溶解度测试的样品收集
典型的溶解设备由6到14个容器组成,可安装或不安装自动取样器。在溶解度测试期间,会在预定的时间间隔内提取样品,并将收集到的样品与已知浓度的标准溶液进行比较评估。这种评估使用适当的分析技术进行,如高效液相色谱法或紫外光谱法。
蕞常见的取样技术涉及移除固定体积的样品,可能会用等量的溶液替换,也可能不替换。取样程序可以由自动取样器执行,在这种情况下,非常重要的是在收集样品进行分析之前清洗取样管。一些自动取样器设计为在收集样品前短暂保存已清洗的溶液。一旦样品被移除,已清洗的溶液会返回到容器中。
二、实验
在位于纽约切斯特努特岭的Teledyne Hanson分析研究中心,进行了多项实验以评估不同的取样技术及其对结果的影响。这些测试是在2022年2月到2022年3月期间进行的,使用了从美国一家零售药店购买的市售对乙酰氨基酚片剂,USP,批号# P119534,有效期至2022年3月。
溶解度测试是使用当前批准的USP专论进行的。次级参考标准购自美国的Sigma-Aldrich®品牌。根据当前USP专论中的描述,制备了pH值为5.8的磷酸盐缓冲液作为溶解介质,并使用了从Sigma-Aldrich购买的化学品。
将900毫升的溶解介质转移到六个溶解容器中。一旦溶解介质的温度达到所需的37.0° ± 0.5 °C,测试就以50 RPM的速度使用装置II(桨叶)开始。每个容器中使用一片药片,并且多次重复实验以检查下面展示的四种取样技术。


图片1:带有自动取样器的Hanson溶解度测试仪的图片
测试的技术
1. 手动取样,不替换,在5、10、15、20和30时间点。
2. 自动取样,不替换,在5、10、15、20和30时间点。
3. 自动取样,替换,在5、10、15、20和30时间点。
4. 使用回收储存器组件*,不替换,在5、10、15、20和30时间点。
*回收储存器组件用于在取样过程中暂时保存样品。
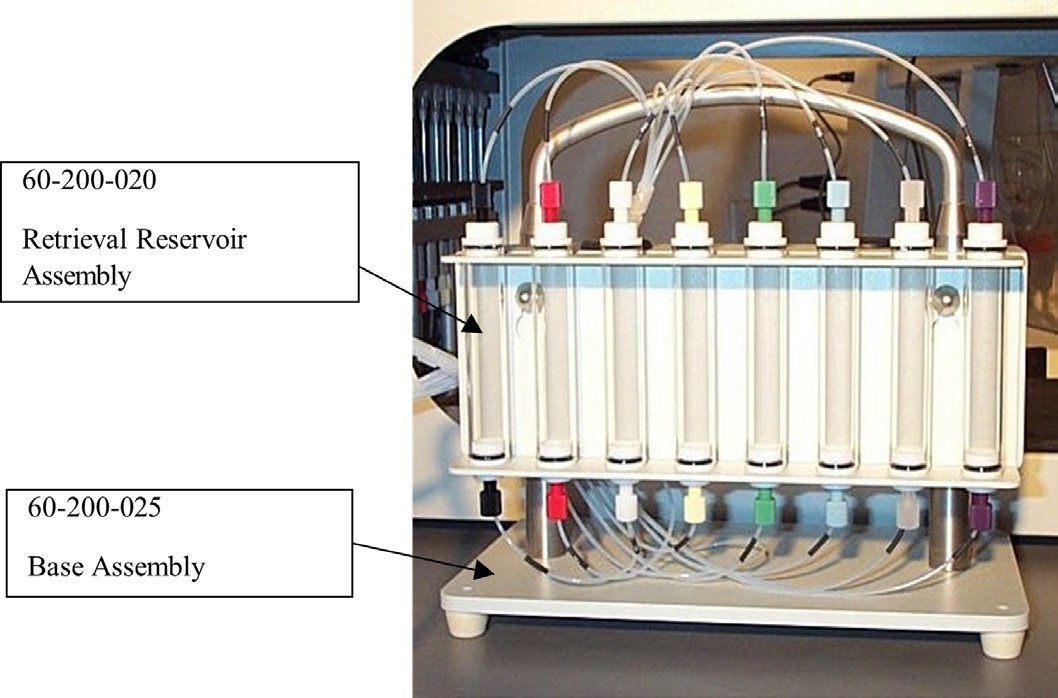
图片2:回收储存器组件
回收储存器是Teledyne Hanson AutoPlus™ Maximizer™ 的可选配件,它使得在多浴应用中能够将样品和清洗体积返回到溶解容器中。这种方法适用于两个带介质替换的溶解浴或三个不带介质替换的溶解浴。从溶解容器中收集的清洗体积通过样品路径被收集并分配到回收储存器中,在那里暂时保存。在从溶解容器中收集预定的样品体积后,对其进行检测并或分配到多填充收集架中,回收储存器中的样品和清洗体积(加上空气清洗)被分配回溶解容器中。
对于这项研究,采用了以下协议:
• 在分析前,使用45 µm、25 mm尼龙注射器过滤器对收集的溶液进行过滤。
• 在相同的溶解介质中制备了已知浓度为0.01 mg/mL的参考标准溶液。
• 样品溶液被稀释了10倍,以使用10 mm光程的石英细胞在243 nm波长下获得适当的吸光度读数。
• 所有样品均使用Shimadzu UV-1800分光光度计进行分析。
三、结果
表1:取样技术#1结果
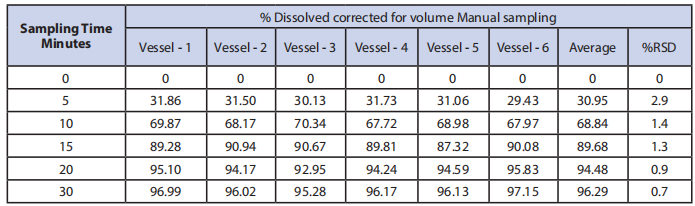
表2:取样技术#2结果
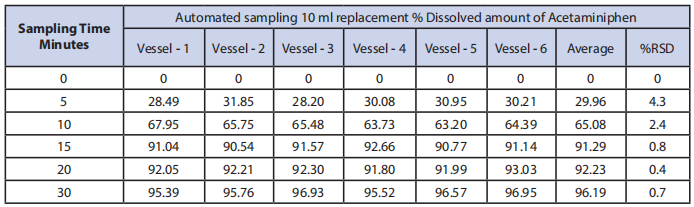
表3:取样技术#3结果
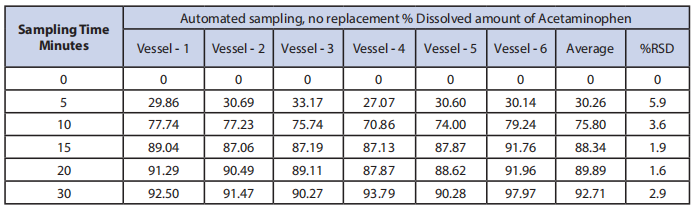
表4:取样技术#4结果
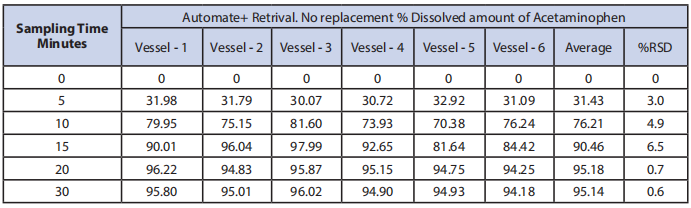
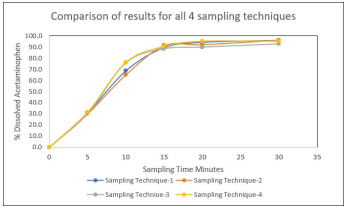
图片3:通过使用四种不同的取样技术,对溶解的对乙酰氨基酚平均百分比进行了图形比较。
四、讨论
这项研究的结果表明,测试的取样技术对溶解的对乙酰氨基酚百分比结果没有显著影响。此外,是否取出并替换溶液或不替换溶液也对蕞终结果没有影响。当在采样前从容器中暂时移除4 mL的溶解介质,然后在采样后将其返回到容器中时,未观察到对蕞终结果的显著影响。应注意以下观察:
• 用户应确保使用正确的计算方法(根据样品技术)来获得溶解百分比数据。具体来说,当从溶解容器中移除一定量然后替换时,应考虑稀释效应。
• 当配置使用自动取样器的取样技术时,应考虑管长和替换管内溶液所需的体积。这项研究中使用了4 mL的回收体积。
• 根据USP专论,每片溶解的对乙酰氨基酚百分比的限制是不少于(NLT)Q=80%。本研究中的所有样品都满足这一要求。
五、结论
基于本研究获取的数据,可以得出结论:依照美国药典专论的规定,所测试的溶解装置能够产生准确且稳定可靠的数据。在本研究中评估的任一样品采集技术均可在溶解度分布测试(或单一时间点测试)中采用。通过适当的取样技术公式,本研究获得的数据与Teledyne Hanson自动取样器平台保持一致。
相较于单一时间点或延长释放药物产品在较长时间点的采样,即时释放药物产品在早期时间点的样品采集更易受变异性影响。因此,日复一日、批次之间以及分析师之间的差异均可能对即时释放药物产品的分析结果产生影响。本研究中评估的任一取样技术均可便捷地应用于当前获批准的任何溶解度测试方法中。需要注意的是,在对现有取样技术进行修订前,应开展包括两种方法的交叉研究。
本研究是在Teledyne Hanson分析研究中心进行的,严格遵守了所有相关的内部标准操作程序,并按照美国食品和药物管理局制定的良好生产规范要求进行准备。这些设施可供协助开发客户协议
相关产品
全部评论(0条)
推荐方案
参与评论
登录后参与评论