反应热是指当一个化学反应在恒压以及不作非膨胀功的情况下发生后,若使生成物的温度回到反应物的起始温度,这时体系所放出或吸收的热量称为反应热。
1、化学反应中能量变化的原因
从微观角度——物质结构看:化学反应的本质是旧键的断裂和新键的生成,旧键断裂时需要吸收能量,新键形成时需要放出能量,化学反应过程的反应热即是这两个过程共同作用的结果。
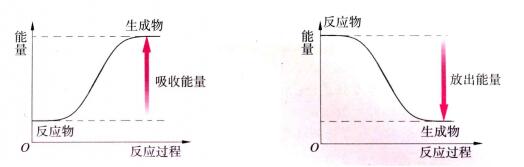
从宏观角度——物质内能看:若反应物的总能量高于生成物的总能量,表现为放热反应,△H<0;若反应物的总能量低于生成物的总能量,表现为吸热反应,△H>0。
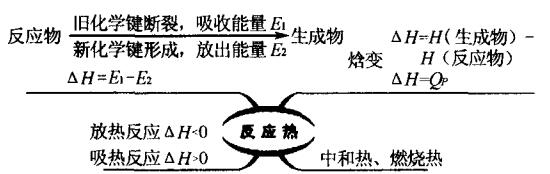
2、焓变(△H)和反应热的关系
在恒压条件下进行的反应,其反应热就是焓变。因此它们的符号均为△H,单位也相同。审题时要特别注意,如果题中说出了“放出”或“吸收”热量,则不用再写“+”、“-”号,热量多少也只看数值。如果题中只说“反应热为……”等,则数值前应标出“+”、“-”,分别表示“吸热”和“放热”。
3、反应热的两种特殊表现形式
燃烧热:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量。
理解时要注意:①量的标准:可燃物必须为1mol;②反应进行程度:完全燃烧,如:C(s)→CO2(g)(不能为CO)、H(g)→H20(l)、S(s)→SO2(g)(不能为SO3)等;③反应产物:生成稳定的氧化物,如:H2+O2→H2O(l)而不是H2O(g);④文字叙述燃烧热时,用“正值”或“△H”表示。例如,CH3OH的燃烧热为1299.6kJ·mol-1或△H=-890.31kJ·mol-1,CH3OH燃烧热的热化学方程式只能写为:CH3OH(l)+(3/2)O(g)=CO2(g)+2H2O(l),△H=-890.31kJ·mol-1。
中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量。
理解时要注意:①稀溶液:是指存在大量水的溶液;②量的标准:必须是生成1mol水;③中和热的实质是H+和OH-化合生成水,若反应过程中有其他物质生成,这部分反应的能量变化也不在中和热之内。即中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离所吸收的热,如1mol稀醋酸溶液和1mol稀氢氧化钠溶液反应生成1mol液态水所放出的热量小于57.3kJ;④即稀强酸与稀强碱反应的中和热为一定值57.3kJ·mol-1。
1、热化学方程式的意义
不论化学反应是否可逆,热化学方程式中的反应热表示反应进行到底(完全转化)时的能量变化。
热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量。如“2H(g)+O2(g)=2H2O(1),△H=-571.6kJ·mol-1”指每2molH2与1molO2反应生成2mol液态水放热为571.6kJ;又如“2SO2(g)+O2(g)⇌2SO3(g),△H=-akJ·mol-1”是指2molSO2(g)和1molO2(g)完全转化为2molSO3(g)时放热为akJ。
若在相同的温度和压强时,向某容器中加入2molSO(g)和1molO2(g)反应达到平衡时,放出的能量为b,则b<AKJ,若向该容器中再通入一定量的SO2,则平衡后A不变,B变大。
2、热化学方程式的书写程序
diyi步:先书写化学方程式并配平,标好各物质的聚集状态(若为同素异形体,则注明名称)。热化学方程一般不写反应条件,不用“↑”或“↓”,有机热化学方程式不用“→”而用“=”。
第二步:依题意,求出方程式系数对应的热量值。
第三步:书写反应热,并注意正负和单位。
3、反应热的大小比较
以“S(s)+O2(g)=SO(g) △H1;S(g)+O2(g)=SO2(g),△H2”为例说明:
diyi种方法:利用△H=H(生成物)-H(反应物)比较。因H[S(s)]<H[S(g)],H(生成物)相同,H(反应物)越小 ,△H越大,即△H1>△H2。
第二种方法:用盖斯定律比较。前式减去后式可得:S(s)=S(g)
△H=△H1-△H2>0故△H1>△H2。
第三种方法:比较反应热△H的大小要注意反应热的数值和符号。若为放热反应,热量越多,△H越小;若为吸热反应,热量越多,△H越大。首先判断上述反应为放热反应,因S(s)=S(g)需吸收热量,因此前一个反应放热较少,△H1而大。
又如:在相同条件下,有如下三个反应:
①C(S)+02(g)=O2(g) △H1
②C(s)+½O2(g)=CO(g) △H2
③C(s)+CO2(g)=2CO(g) △H3
则它们的反应热△H的大小顺序为△H3>△H2>△H1。
4、用盖斯定律的计算反应热的程序
书写目标方程式并标好相应物质的聚集状态→对照已知方程式和目标方程式,以目标方程中没有的物质为着眼点→调整目标方程式中没有但已知方程式含有的物质的系数,使之相等→叠加方程式,消掉目标方程式中没有的物质→得出目标方程式的反应热→整体检查,判断正误。
注意事项:热化学方程式的叠加类似于整式的运算,叠加时应遵循数学的运算规则,当需要将某一热化学方程式同乘以某一化学计量数时,各物质前的化学计量数和△H需同乘以该化学计量数。“△H”在进行加、减、乘等运算时,一定要注意其符号的改变,即△H的运算包括数值和符号的双重运算。