化学反应速率是指表示化学反应进行的快慢。通常以单位时间内反应物或生成物浓度的变化侦(减少值或增加值)来表示,反应速度与反应物的性质和浓度、温度、压力、催化剂等都有关,如果反应在溶液中进行,也与溶剂的性质和用量有关。
一、化学反应速率影响因素分析
一般来说,对于化学反应速率造成影响的因素比较多,根据内因而言取决于反应物的化学性质,如果化学性质比较活泼,那么化学反应速率就很快;如果化学性质不活泼,那么化学反应速率就很慢。
而导致化学反应的外部因素也比较多,包含了温度、化学反应物的浓度、气态反应物压强、固体反应物表面积、溶剂、电磁波等等,这些均对于化学反应速率起着不同程度上的作用。因此,作为高中学生,在解答该种类型的化学问题时,需要注意到产生这些因素的差异性。
例如,将铝条放在装有过量稀盐酸的试管里面,不会对氢气产生速率的影响因素是:diyi,铝条表面积;第二,溶液温度;第三,盐酸浓度;第四,添加少量的硫酸钠。
分析:在这一化学问题之中,反应物盐酸浓度会直接影响到氢气产生速率,因此第三个选项是不正确的。其次,固体反应物表面积也会直接影响到氢气产生速率,所以diyi个选项也是不正确的。Z后,溶液的问题会影响氢气产生速率,因而第二个选项同样是不正确的,经过逐一分析,答案已经出来了,就是第四个选项,添加少量的硫酸钠。
二、化学平衡状态分析
分析可逆反应在给出的条件下是否已达到平衡,可通过观察逆反应与正反应是不是一样,以及对容器里面各个反应混合物浓度是不是维持不变进行判断,如果可变量不产生改变,那么就表明化学反应平衡。
比如:维持一定的温度,在封闭的容器里面产生了这样的可逆反应:X(g)+3Y(g)⇌2Z(g),那么请问反应平衡状态的标志是:diyi,生成物Z的速率与其分解速率一样;第二,在相同时间中,生成的nmolX时也生成了3nmolY;第三,X、Y、Z这几种物质分子个数比是1:3:2;第四,在容器里面的化学混合物密度不会随着时间而产生变化。
解析:通过审题可以知道Z的生成与分解就是可逆反应的正反应与逆反应速率,假设逆反应与正反应速率一样,就表明这个反应达到了平衡状态,因此diyi个选项是正确的。在容器里面由于气体总质量并未产生变化,并且容积也未产生变化,这就说明其密度同样不会产生变化,所以不管反应是不是达到了平衡状态,第四个选项均与题目所要表达的意思不相符。在可逆反应里面不管反应是不是平衡,生成的nmolX的时候一定会生成3nmolY,因而,第二个选项也无法判断出反应是不是平衡的标志。X、Y、Z这几种物质分子个数是1:3:2不能阐明混合物浓度不变,所以,是不正确的。Z后的正确答案就是diyi个选项。
三、化学反应速率计算
高中学生在解决化学反应速率计算题的过程中,首先需要了解化学反应速率的基本概念以及计算公式,并且区分计算的物质是生成物还是反应物。化学反应速率表示的是反应的平均速率,计算值通常是取正值。在高中化学反应中各个物质的化学反应速率比和其化学计量数之比是相等的,并且也与单位时间中各种物质的浓度变化量之比以及各个物质参与反应的物质的量之比相等。
比如,在一定温度情况下,封闭的容器之中有2L的x、y、z气体,这几种气体量伴随着时间的改变关系,(见下图),依照图形判断以下哪一种说法是对的:diyi,反应开始到10s的时候,x气体物质的量浓度降低了0.79mol·L-1;第二,反应的化学方程式就是X(g)+Y(g)⇌Z(g);第三,反应开始到10s的时候,Z气体表示的反应速率就是0.158mol·(L·s)-1;第四,反应开始到10s的时候,Y气体转化速率是79%。
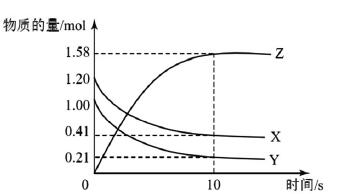
解析:高中学生对化学反应速率进行解答的过程中,需要看清楚坐标所表述的是物质浓度还是量的变化。其次,应当计算清楚曲线的变化方向,进而依据曲线变化方向判断是生成物还是反应物。曲线里面的物质浓度或者量提高的是生成物,下降的是反应物。使用这部分基本概念与规律等分析该问题。10s以内,Z浓度变化量是1.58mol/2L=0.79mol·L-1,使用Z表示反应速率就是v(Z)=0.79mol·L-1/10s=0.079mol·(L·s)-1,因此第三个选项是不正确的。
通过观察图像可以了解到X反应了0.79mol,X物质浓度降低了0.395mol·L-1,所以,diyi个选项是不正确的。从反应开始到10s的时候,参加反应的Y气体物质量是0.79mol,浓度是0.395mol·L-1,那么使用Y表示的化学反应速率就是0.0395mol·(L·s)-1,因此,第四个选项是正确的。所以,该问题的正确答案就是第四个选项。
高中学生要提升化学反应速率与限度的解题精确性与效率,除去要仔细审题,了解题目所要表达的真正意思,还需要增强对问题的分析能力,进而找到问题解决的技巧,如此才可以提高化学问题的解题速度。