操控大脑活动:光遗传技术让神经元控制从科幻到现实!
一、经典的电影情节:操控大脑!
如果看过电影《超体》的同学,想必一定对这一幕印象深刻——被强迫帮人送货的年轻女子露西,遭遇了穷凶恶极的黑帮头目一伙。她连同三个男人被张先生在腹部缝入了神秘药品,以此将药品偷偷带入不同国家。在台北盘桓期间,露西遭到暴打,以致药品破裂进入血液之中
谁知令人难以置信的事情就此发生,药品激发了露西大脑的潜力,令人脑中约90%的神经元相继苏醒。伴随着身体的飞快进化,露西掌握了越来越多人们所谓的超能力
关于各种途径控制大脑活动的科幻题材已流行数十年,实际上,其中药物、电刺激、磁刺激等途径在人类临床上目前已得到了广泛应用

电影《超体》海报
二、光可以控制大脑吗?
以往的科幻电影中,关于人类脑控制主要通过化学物质、意念、电刺激等五花八门的形式,但在1997年上映的一部电影《黑衣人》中,我们看到一个场面,特工处理完外星人出没现场之后会掏出一个发光棒,让围观群众“往这儿看”, 随后强光一闪,围观者的短时记忆就被抹去,不再记得见过奇怪外星生物的经历。不难看出在二十多年前,人类就进行了对光控制大脑的探索和遐想,而这在当时只是电影的科幻题材
那么现在,真的有这样的技术,能够用光来控制大脑吗?当然有,那就是通过光遗传学方法,虽然没有电影里“强光一闪”表现得那么简单,但也能够实现对大脑的控制
 电影《黑衣人》剧照
电影《黑衣人》剧照
三、光遗传学的出现
实际上,我们的科学家早从21世纪初就开始了对光和大脑之间关系的探究
2002年,斯隆凯特琳癌症研究中心的Gero Miesenböck教授率先尝试了这个大胆的想法,他把来自无脊椎动物的感光蛋白表达在大鼠细胞上,并在培养皿中看到了神经元响应光刺激的现象
2005年,斯坦福大学Karl Deisseroth实验室通过在神经细胞中表达光敏蛋白,响应不同波长的光刺激实现对神经功能的调控,宣布人类正式拥有了精准操控大脑的工具
2006 年, Karl Deisseroth提出光遗传学(Optogenetics),并与26岁的Edward Boyden一起,开创光遗传学时代
Nature Methods杂志评选出2010年度研究方法——光遗传学(Optogenetics),并在十周年之际推出了纪念特刊点评了在过去十年中对生物学研究影响很深的十大技术,其中就包括光遗传学技术
2015年,Nature Neuroscience杂志为纪念光遗传学十周年特地撰文,直言“光遗传学打开了通往梦寐以求实验的大门”,甚至有科学家预言:“光遗传学注定会获得诺贝尔奖”
四、什么是光遗传学?
在经典的生物学实验中,控制神经细胞需要一些比较粗暴的手段,如电刺激、损伤脑区或是化学物质干预。实验效果往往不尽人意,而光遗传方法可通过控制单个神经元很好地解决了这个问题
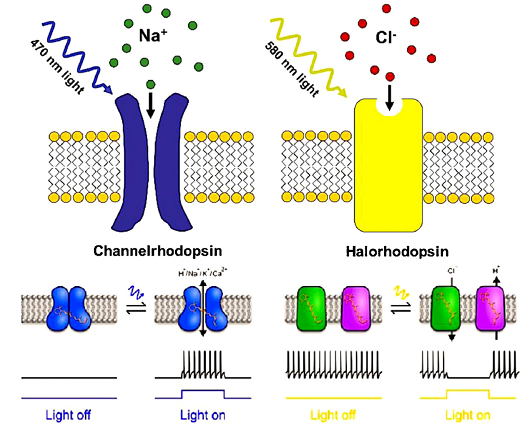
光遗传学是遗传学(重组DNA技术)与光学相结合的一种细胞生物学研究技术方法。通常利用病毒载体或者转基因技术手段在受体细胞中表达光受体(光敏蛋白)离子通道,通过特异波长的光进行定向性的激活或抑制细胞的发放电活动。
实验流程
Step 1:将光敏蛋白基因在目标细胞内表达:将载有光敏蛋白的病毒转染进入目标细胞内,通过启动子等将光敏蛋白表达在细胞膜上。
Step 2:植入光纤导管或光遗传电极:向注射病毒的位置植入光纤导管,通过光纤导管输入特定波长的光刺激,以启动或抑制光敏蛋白。
Step 3:采集光刺激的生理效应:光刺激之后的细胞、组织或生物体会出现相应的生理上或行为上的变化,通过脑电肌电采集、脑内神经递质检测或行为视频采集可将光遗传引起不同维度的改变记录下来。
在早期的光遗传学实验中,通常是对动物的大片脑区施加光刺激,这种情况下的光刺激远远超出了实验所需要的强度。随着光遗传学工具的改进和对实验对象脑区更精确位置的定位,通过光纤更为精准地进行光刺激正成为光遗传技术的关键。
 这只被植入了光纤导管的小鼠登上了无数的期刊
这只被植入了光纤导管的小鼠登上了无数的期刊
五、美国Pinnacle光遗传系统
值得注意的是,光遗传只是一个研究工具,通俗的说,是一个用光控制脑神经活动的开关,并不具有检测功能。
科学家们在进行动物脑研究时,为了检测光刺激的效应,往往需要搭配脑电肌电采集、脑内神经递质检测、行为视频录制等模块进行多维度分析。

美国Pinnacle光遗传学系统则在光遗传刺激模块基础上,将专业的脑电肌电采集、神经递质检测和行为视频采集等模块集成为高度兼容的一站式系统。可支持研究者从植入光纤探针、实行特定波长的光刺激到采集刺激前后动物生理学、行为学变化的全部实验过程。

相较于市面同类设备功能单一的特点,美国Pinnacle光遗传学系统是一套简单而直接的广泛应用于大小鼠光遗传学实验的设备。
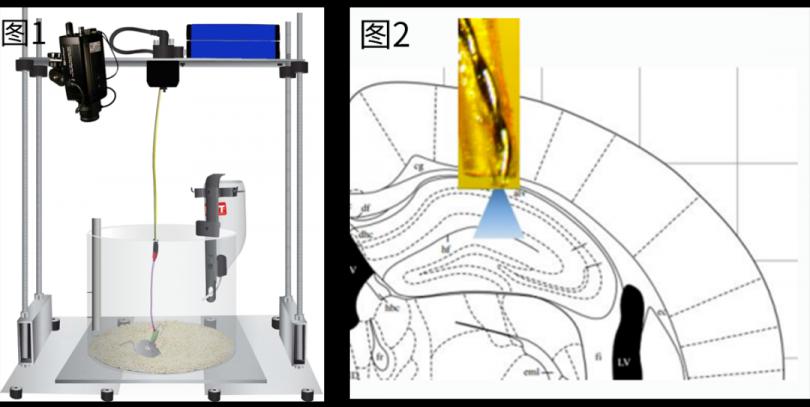
行为视频采集+神经递质检测+脑电肌电采集+光刺激系统组成(图一)
光刺激神经元活动(图二)
系统特点
1. 可自由搭配脑电肌电信号采集、神经递质检测、行为视频采集系统使用,配置灵活性高。
2. 光刺激采用电转换器驱动光纤探针,无需额外配置光转换器。
3. 多种波长的LED探针可选,若需更换不同波长光刺激,只需更换探针即可,应用广泛,使用成本低。
4. 时间控制精度高,可达毫秒或亚毫秒级别。
5. 光刺激空间的特异性和对通道蛋白的特异性强
6. LED光源作用直接,光刺激热效应对动物损伤小
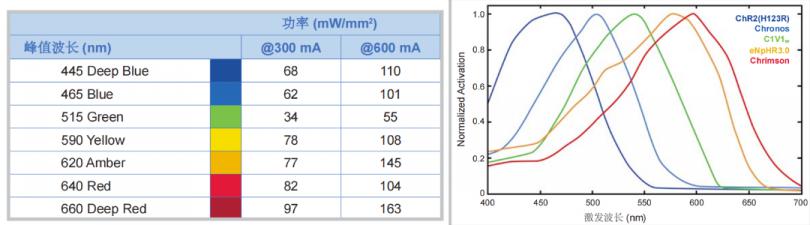
多种波长的LED探针选择
六、光遗传研究系统应用方案
光遗传系统搭配脑电肌电采集系统
Pinnacle光纤探针的套管和预制头帽通过牙科水泥固定在动物头骨上,同时通过在脑内光刺激对应的位置或皮层植入脑电电极来采集动物的脑电信号
系统可测量光刺激前、中、后的神经元放电活动,精准记录光刺激对神经元产生的激活或抑制作用

光遗传系统搭配生物传感器
光遗传学搭配生物传感器,在给予光刺激的同时检测脑内神经递质的浓度变化,可以更好地研究脑区神经元网络功能和行为的关系。下图显示了光遗传学技术与脑电采集系统、生物传感器相结合的实验结果。
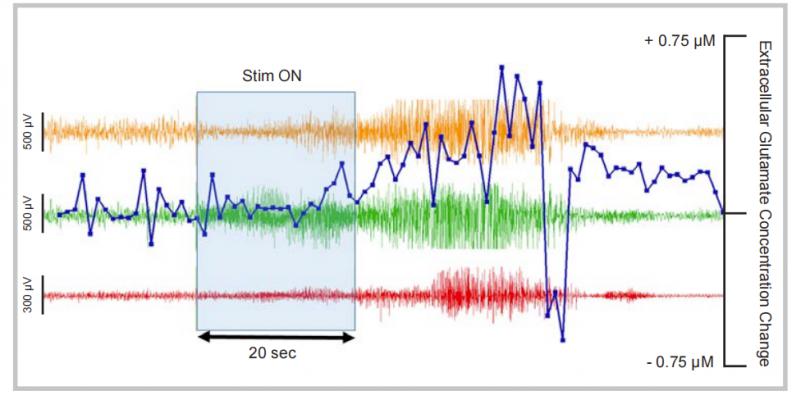
在表达视紫红质-2的转基因小鼠脑区通过手术植入两通道皮层脑电图记录电极(EEG1、EEG2),在右侧海马区植入LED光线探针和深层电极,并在右侧额叶皮层植入谷氨酸生物传感器
手术后一周用蓝色(445nm)的给与光刺激20秒。在刺激中和刺激后三通道的电极均记录到明显的癫痫发作活动,这便是通过光遗传方法激活了相应的神经元
通过生物传感器亚秒级检测右侧额叶皮层的谷氨酸释放情况,实时亚秒级数据变化可与光遗传刺激精确计时完美同步,数据显示谷氨酸的浓度变化与癫痫发作紧密相关,在癫痫发作事件结束后谷氨酸浓度急剧下降
光遗传搭配FSCV系统
Pinnacle的光遗传/快速扫描循环伏安法(FSCV)集成系统为大小鼠光遗传结合FSCV神经递质检测实验提供了一个简单有效的解决方案
研究人员可以将光遗传学与电化学记录无缝集成,可检测动物脑内神经递质释放,为光遗传实验光刺激前后神经递质的电化学检测提供了有力的工具
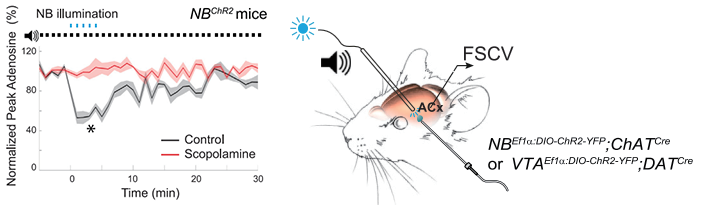
图:分别对空白对照小鼠和东莨菪碱治疗小鼠进行光遗传刺激实验,分别记录NB光刺激前、刺激中和刺激后两组小鼠脑内腺苷浓度变化曲线图。
七、更多应用案例
案例一
将编码视紫红质通道蛋白-2的病毒注射到大鼠上丘深层和中间层,并在同一部位植入头戴式LED光纤探针,使用毛果芸香碱诱导Sprague-Dawley大鼠癫痫持续发作,并维持到自发性发作,然后用5Hz或100Hz的光刺激该脑区,并监测大鼠癫痫发作次数、发作持续时间和癫痫发作行为。
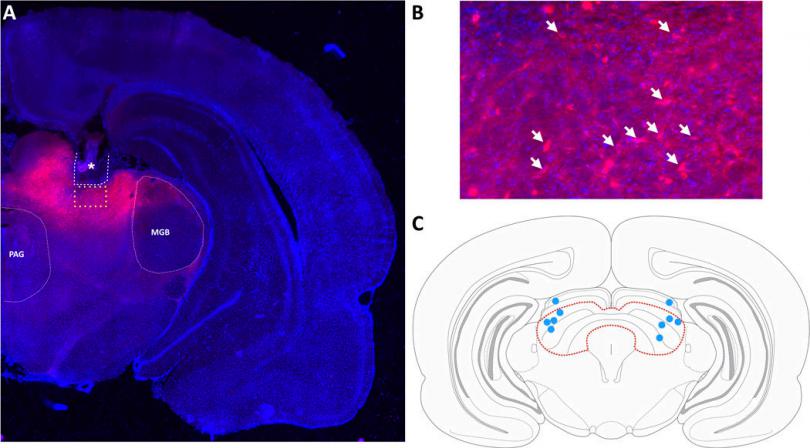
图A:*处为光纤探针和套管的植入位置;图B:箭头表示mCherry阳性(表达chr2)神经元细胞;图C:脑图谱冠状面上丘深层和中间层。
——Safwan K. Hyder, et al., Optogenetic activation of the superior colliculus attenuates spontaneous seizures in the pilocarpine model of temporal lobe epilepsy
案例二
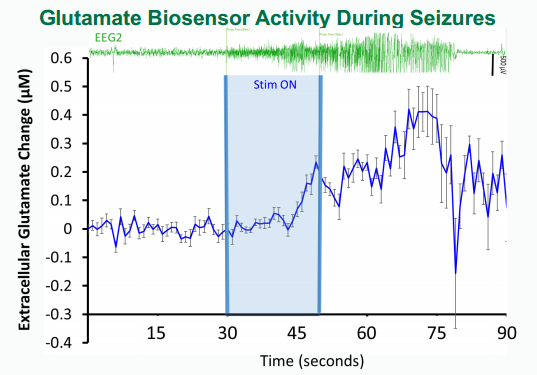
在表达视紫红质通道蛋白-2的转基因小鼠的海马体中植入套管和深度电极以及两个皮层电极。在前额叶皮层放置了第二根套管用于记录谷氨酸变化。
手术后一周,将蓝色(445nm)LED光纤探针插入引导套管中。在20 Hz和10%的占空比下进行>100mW/mm2的刺激,为了激发癫痫活动,每只动物刺激10或20秒,每天6次(3小时内每30分钟一次),持续2-7天,观察光遗传刺激诱发癫痫发作的脑电信号及脑内谷氨酸浓度的变化。
——Erik Naylor, et al., Integration of Optogenetic Stimulation with Neuronal and Neurotransmitter Recordings - Kindling Using Optogenetics
部分用户名单
北京大学 | 中科院神经所 | 北京脑科学与类脑研究中心 |
复旦大学 | 大连医科大学附属医院 | 中国医学科学院生物医学工程研究所 |
北京针灸所 | 山东第一医科大学 | 内蒙古工业大学 |
安徽医科大学 | 南方医科大学 | 第二军医大学 |
部分参考文献
[1].Liu, Q., et al., A clock-dependent brake for rhythmic arousal in the dorsomedial hypothalamus. Nature communications, 2023. 14(1): p. 6381.
[2].Hyder, S.K., A. Ghosh and P.A. Forcelli, Optogenetic activation of the superior colliculus attenuates spontaneous seizures in the pilocarpine model of temporal lobe epilepsy. Epilepsia, 2023. 64(2): p. 524-535.
[3].Campos-Rodriguez, C., D. Palmer and P.A. Forcelli, Optogenetic stimulation of the superior colliculus suppresses genetic absence seizures. Brain, 2023. 146(10): p. 4320-4335.
[4].Huffman, D., et al., A real‐time sleep scoring framework for closed‐loop sleep manipulation in mice. Journal of Sleep Research, 2021. 30(4): p. e13262.
[5].Gao, C., et al., Two genetically, anatomically and functionally distinct cell types segregate across anteroposterior axis of paraventricular thalamus. Nature neuroscience, 2020. 23(2): p. 217-228.
[6].Jiang-Xie, L., et al., A common neuroendocrine substrate for diverse general anesthetics and sleep. Neuron, 2019. 102(5): p. 1053-1065. e4.
[7].Pedersen, N.P., et al., Supramammillary glutamate neurons are a key node of the arousal system. Nature communications, 2017. 8(1): p. 1405.
[8].Zant, J.C., et al., Cholinergic neurons in the basal forebrain promote wakefulness by actions on non-cholinergic neurons: an opto-dialysis study. Journal of Neuroscience, 2016. 36(6): p. 2057-2067.
[9].Soper, C., et al., Optogenetic activation of superior colliculus neurons suppresses seizures originating in diverse brain networks. Neurobiology of disease, 2016. 87: p. 102-115.
[10].Ito, H., et al., Analysis of sleep disorders under pain using an optogenetic tool: possible involvement of the activation of dorsal raphe nucleus-serotonergic neurons. Molecular brain, 2013. 6: p. 1-10.
全部评论(0条)
推荐阅读
-
- 操控大脑活动:光遗传技术让神经元控制从科幻到现实!
- 果看过电影《超体》的同学,想必一定对这一幕印象深刻——被强迫帮人送货的年轻女子露西,遭遇了穷凶恶极的黑帮头目一伙。她连同三个男人被张先生在腹部缝入了神秘药品,以此将药品偷偷带入不同国家。
-
- 操控大脑活动:光遗传技术让神经元控制从科幻到现实!
- 果看过电影《超体》的同学,想必一定对这一幕印象深刻——被强迫帮人送货的年轻女子露西,遭遇了穷凶恶极的黑帮头目一伙。她连同三个男人被张先生在腹部缝入了神秘药品,以此将药品偷偷带入不同国家。
-
- 光遗传为什么给光就能激活或抑制神经元?
- 光遗传为什么给光就能激活或抑制神经元?
-
- 从理想到现实 | 一个追光者的STED使用史
- 从理想到现实 | 一个追光者的STED使用史
-
- MTTC雷娟:让医疗科技成果转化从偶然到必然
- 如何更好地为成果转化赋能?
-

- 日立学堂|从产品到服务,从开始到开始
- 日立电镜从事电子显微镜的研究和商业化,始于1941年。在电镜的技术研发上,始终坚持自己的思路,任由他人日月轮回,几番浮沉。
-

- 洁净度自动分析:从 Aspex 到 ParticleX,从优秀到卓越
- 从落地式的 Aspex 到桌面式的 ParticleX,得益于 CeB6 单晶体灯丝的优良性能,以及内置了一套常规电镜操作系统,可完全实现常规电镜功能的同时,又可以实现强大的自动化测试。
-

- 光固化3D打印机从SLA,DLP到LCD,3次技术迭代
- SLA 3D打印技术使用激光器作为光源,通过透镜聚焦后的激光束,按照设备指令将截面轮廓沿着液面进行扫描,扫描区域的树脂快速固化。然后,工作台再下降一层截面厚度的高度,
-

- 光遗传蓝光刺激功率如何选择?
- 根据文献记录,蓝光的刺激功率建议不要超过40mW,这与光敏蛋白本身的特性相关。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
最新话题
最新资讯
- 欢迎申报中国材料研究学会科技成果评价
- 机场前瞻 | Raythink燧石技术机场立体防控解决方案引领行业新方向!
- Cytiva专题研讨会即将开启,一起见证抗体纯化技术驱动行业升级!
- 拥抱开放与互联,实验室管理系统开启新篇
- 英王查尔斯三世访问罗马,了解ICOS生态系统测量技术
- 助力科研进阶!国仪量子EPR交流会桂林理工大学站成功举行
- 国仪量子微孔分析仪SiCOPE 40亮相中科院三大院所,赋能微孔材料研发新突破
- 福立亮相第八届全国化学工程与生物化工年会:创新驱动赋能绿色化工未来
- 央媒访谈:马楫会长受邀央媒《新质生产力·强国智造》栏目访谈,澄峰科技无人船 “实力出圈”
- 展讯速递|三展同辉,长城科工贸5月三大展会信息先知!
作者榜























参与评论
登录后参与评论