产品介绍:
ForceRobot 400
力在分子机制中起着至关重要的作用,如识别、反应和信号传递。 ForceRobot® 400生物型AFM结合了许多独特的力谱创新技术以在单分子水平上测量力。它能够量化单个分子键的机械强度,并对分子相互作用和生物分子复合物的力依赖特性进行表征。
理解单分子力学
ForceRobot 400具有独特的能力,能够为功能性生物机制提供关键见解,为生物物理学、生物化学、发育生物学和新型治 疗分子的开发等研究领域带来新的可能性。
ForceRobot 400能提供:
优异的表现:每天250,000条力曲线
完全自动化的单分子力谱测量
生物医学以及前临床研究需要的统计学相关的,标准化的数据集
先进的力曲线设计以及广泛的拟合程序,实现灵活实验设计
独 创的多参量纳米力谱
ForceRobot 400可以在接近生理条件下对单个分子进行无标记的纳米力学测量。可以收集高质量相关的、多参量的数据集,并从每个数据集中自动得出全面的生物物理参数。
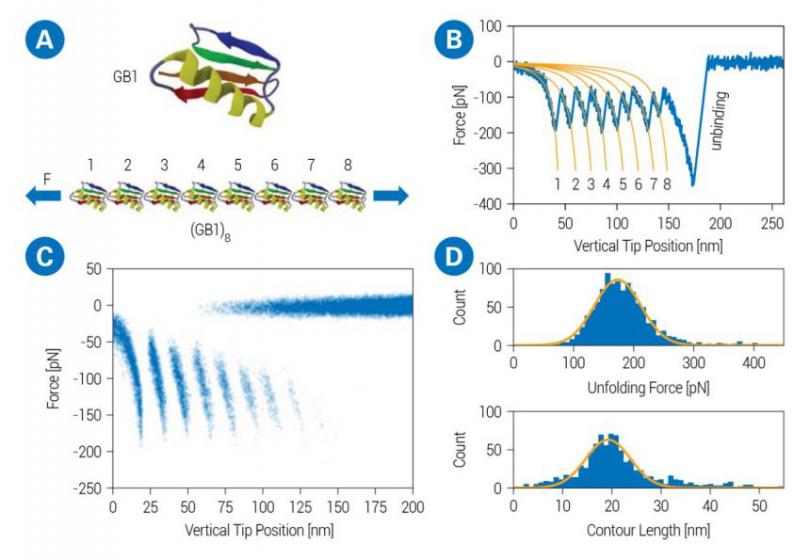
对(GB1)8多聚蛋白的SMFS测量与力曲线的统计分析。A: 单个GB1分子(鸟嘌呤核苷酸结合蛋白)和相应的由GB1的8个串联重复序列组成的多聚蛋白的三维示意图。(结构2J52来自www.rcsb.org,用于显示GB1)。B:力距(FD)曲线示范性地展示了(GB1)8的所有8个亚单位的完全展开。每个展开的GB1亚单位的轮廓长度是通过用蠕虫状链模型(橙色)拟合FD曲线来确定的。C: 叠加的FD曲线的密度图,表明8个亚单位展开的概率。D: GB1亚单位的轮廓长度和展开力值的分布。确定平均轮廓长度为19.2纳米,平均展开力为173pN。样品由中国南京大学物理系曹毅教授提供。
“自动化水平的提高,加上先进的光学技术,使新的ForceRobot 400成为在单分子尺度上研究生物物理现象的杰出工具。这种测力能力使人们能够在单分子水平上研究天然和合成聚合物的机械性能,推进了新型宏观和纳米材料的设计和合成。”
---来自中国南京大学物理系曹毅教授

先进的自动化力谱测量
ForceRobot 400是SMFS的理想工具,为分子水平的生物物理机制提供了关键的见解。大尺寸的Z轴电机和增强的电动化样品台功能使其能够对从单分子到更大的生物复合物,以及相距较远或处于不同样品区的感兴趣区域(ROI)进行研究。最 新的可选NestedScanner具有一个带电容传感器的快速Z轴扫描器。它即使在高速下也能生成可重复的力曲线,大大扩展了微观流变学测量的频率范围。
新的SmartMapping功能允许灵活选择多个、用户定义的二维力图。利用光学tiling,可以提前选择多个ROI并自动测试,便于对大样本区域进行系统研究。
树立单分子力谱自动化测试的新标准
ForceRobot 400具备飞快的数据采集速率,先进的自动化和分析能力。结合专有的软件,自动对焦和校准功能确保了自动化操作和快速结果。
极 致的灵活性
新的ForceRobot 400用户界面,具有直观的用户指导,能够快捷地定义操作参数。预先定义的实验设置,如力钳、力 或微流变学,结合易用的编辑工具,允许用户定义实验设计。得益于系统参数的自动调整,可以进行长期的、自我调节的系列实验。
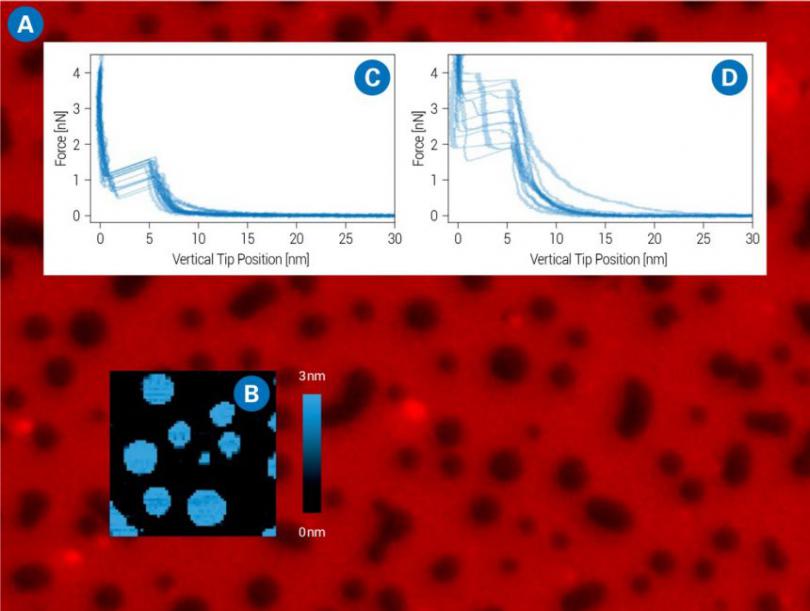
突破性的能力
一小时超过10,000条力曲线
检测系统自动对焦及自适应环境条件
探测粗糙表面的新型自动化自我调整的成像模式
调制频率高达至少5kHz的粘弹物性表征(需要可选的Z轴扫描管)
广泛的环境控制配件(湿度,温度,离子强度,缓冲液交换等)
与光学显微镜无缝结合
ForceRobot 400可以与先进的光学和超分辨率技术无缝集成,提供相关的纳米力学数据集,并对各种各样的生物样本进行全面表征。
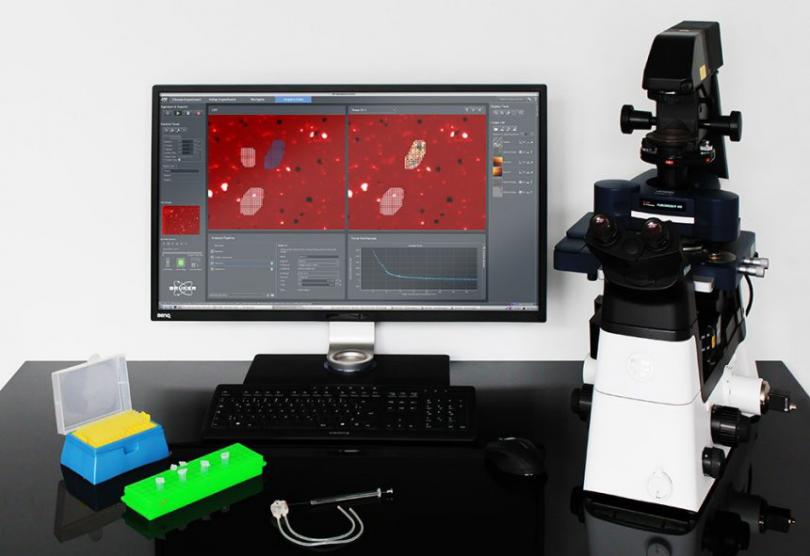
ForceRobot 400 on Nikon Eclipse Ti2 inverted microscope and intuitive software interface.
在尼康Eclipse Ti2倒置显微镜上的ForceRobot 400以及直观的软件界面。
用ForceRobot 400 可以研究:
分子层面蛋白质的功能
分子生物力学和受体-配体类型键
用于免疫诊断的新型抗体-抗原复合物的检测和动力学研究
不同物质的粘弹性
最 大的粘附力,单个结合和去结合事件的机理
单个分子和分子排列的分子内特性
大分子的结构变化
利用ForceRobot技术发表学术论文选集
Fernandez et al., AFM-Based Force Spectroscopy Unravels Stepwise Formation of the DNA Transposition Complex in the Widespread Tn3 Family Mobile Genetic Elements. Nucleic Acids Research, gkad241 (2023)
Dupuy et al., Molecular Device for the Redox Quality Control of GroEL/ES Substrates. Cell 186 (5), 1039-1049.e17. (2023).
Li et al., Active Microrheology of Protein Condensates Using Colloidal Probe-AFM. Journal of Colloid and Interface Science, 632, 357–366 (2023).
Blaimschein et al., Substrate-Binding Guides Individual Melibiose Permeases MelB to Structurally Soften and to Destabilize Cytoplasmic Middle-Loop C3. Structure 31 (1), 58-67.e4 (2023).
Serdiuk et al., A Cholesterol Analog Stabilizes the Human β 2 -Adrenergic Receptor Nonlinearly with Temperature. Sci. Signal. 15 (737), eabi7031 (2022).
Petitjean et al., Multivalent 9-O-Acetylated-Sialic Acid Glycoclusters as Potent Inhibitors for SARS-CoV-2 Infection. Nat Commun 13 (1), 2564 (2022).
Lee et al., Modified Cytosines versus Cytosine in a DNA Polymerase: Retrieving Thermodynamic and Kinetic Constants at the Single Molecule Level. Analyst 147 (2), 341–348 (2022).
Lei et al., An Ester Bond Underlies the Mechanical Strength of a Pathogen Surface Protein. Nat Commun 12 (1), 5082 (2021).
Wang et al., Living Materials Fabricated via Gradient Mineralization of Light-Inducible Biofilms. Nat Chem Biol 17 (3), 351–359 (2021).
Liu et al, High Force Catch Bond Mechanism of Bacterial Adhesion in the Human Gut. Nat Commun 11 (1), 4321 (2020).
Zhang et al., Dynamic Topology of Double-Stranded Telomeric DNA Studied by Single-Molecule Manipulation in Vitro. Nucleic Acids Research 48 (12), 6458–6470 (2020).
Sun et al., Molecular Engineering of Metal Coordination Interactions for Strong, Tough, and Fast-Recovery Hydrogels. Sci. Adv. 6 (16), eaaz9531 (2020).
Huang et al., Maleimide–Thiol Adducts Stabilized through Stretching. Nat. Chem. 11 (4), 310–319 (2019).
Tiu et al., Enhanced Adhesion and Cohesion of Bioinspired Dry/Wet Pressure-Sensitive Adhesives. ACS Appl. Mater. Interfaces 11 (31), 28296–28306 (2019).
布鲁克纳米表面仪器部
仪器网(yiqi.com)--仪器行业网络宣传传媒