| 行业应用: | 仪器仪表 仪器仪表 |

衰减全反射傅里叶变换红外光谱(ATR-FTIR)是分析生物流体的一种理想技术。红外光谱记录分子键振动,可以获得生物样品的红外指纹图谱。医疗保健研究人员和临床医生关注“液体活检”(一种微创的样本收集方法)。许多生物液体,如尿液、唾液和血液,可以使用ATR-FTIR进行研究。利用生物液体样品之间的光谱差异,可以区分健康患者和患病患者。
血液是医学诊断中应用Z广泛的生物液体,它由血浆、红细胞、白细胞和血小板组成。对于光谱分析,通常使用血浆或血清,因为这两种液体可以冷冻保存。血液的冷冻过程会导致细胞破坏,血红蛋白对光谱信号影响很大。血浆是在抗凝管中离心分离的水溶液,而血清是通过血液凝固分离血细胞和血小板得到的,如图1。血清更常用,因为血清的制备方法可以有效地去除红细胞。
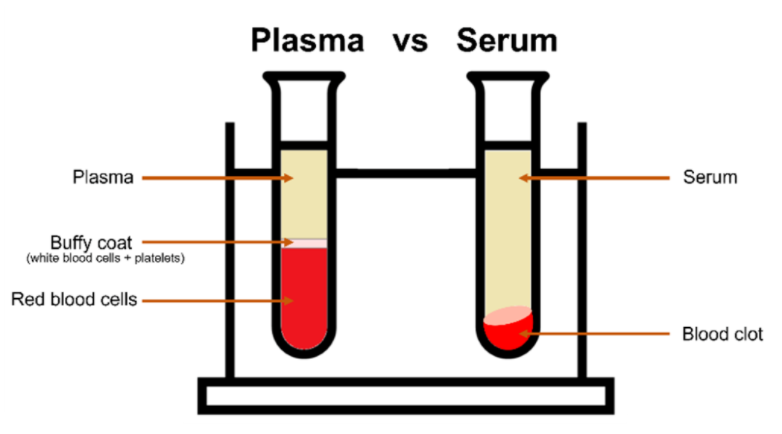
图1 血浆和血清
ATR-FTIR技术在中红外区域(4000cm-1~400cm-1)检测生物样品(如蛋白质、脂质和氨基酸)中功能基团的基本振动,仅需要几微升的小样本量,即可提供快速的结果;同时也是一种节约成本、易于使用的诊断方法。ATR-FTIR技术进行血清分析已用于许多疾病研究,如癌症、子宫内膜异位症、脑部疾病和病毒感染1~6。
水对生物液体测试的影响
ATR-FTIR技术在进行生物液体样品分析时,水会对红外光谱的产生影响,图2。水的极性很强,会产生强烈的红外响应;当使用ATR-FTIR分析生物流体样品时,水的红外光谱掩盖了样品中的生物信息。通常,在检测生物液体时,测试者必须等待样品干燥;这很耗时,并延长了总测试时间。更快的方法是使用加热ATR附件。通过加热样品,水分蒸发得更快,总测试时间显著减少。本文使用加热ATR附件的IR5红外光谱仪,去除水分并快速测量血清样本的光谱。
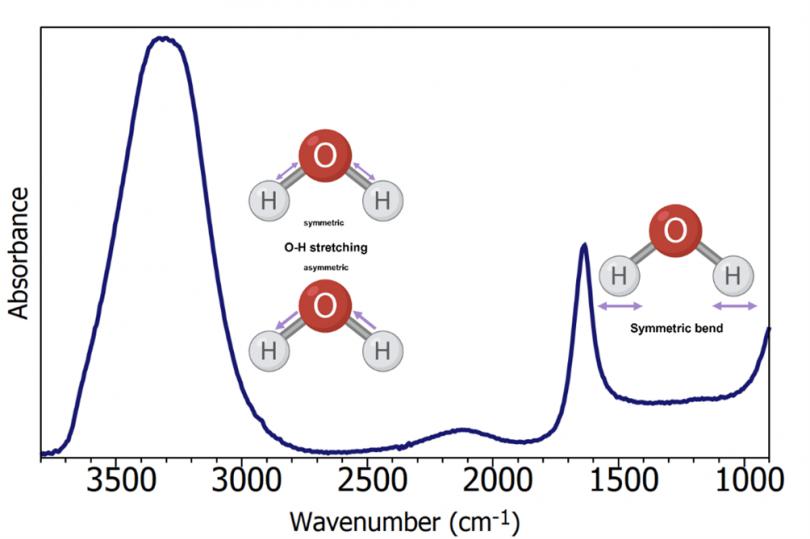
图2 红外光谱中的水峰
实验设备及方法
配有加热ATR附件的爱丁堡IR5傅里叶变换红外光谱仪,测量人类血清白蛋白样本。ATR的反射晶体选择金刚石材质(高折射率和耐用性)。由于其优异的导热性,金刚石ATR附件适合于加热实验。

图3 IR5傅里叶变换红外光谱仪(a)和ATR加热附件(b)
为了验证加热ATR附件对干燥时间的影响,将3μL样品移液到ATR上,不加热ATR采集光谱。ATR预热并保持在50℃恒定,重复此过程。红外光谱的分辨率设置为4cm-1,扫描10次,每个光谱的总测试时间为35秒。
结果与讨论
人血清白蛋白在室温下干燥2分钟(蓝色)和ATR加热(红色)的红外光谱,如图4所示。在室温ATR测量中,光谱以水的吸收峰为主,生物光谱信息被覆盖。使用加热ATR可获得无水干扰的完整生物光谱。如果将蓝色光谱样品在室温下干燥,需要超过15分钟的干燥时间,生物光谱才能充分显示,这大大降低了测量通量。
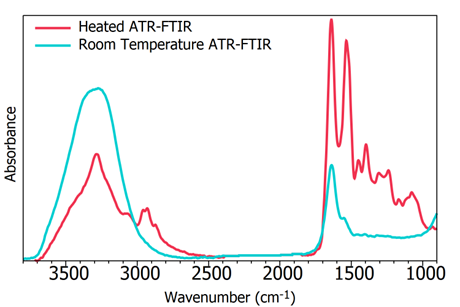
图4 人类血清白蛋白的ATR-FTIR光谱图
(蓝色:室温下干燥2分钟;红色:加热至50℃干燥)
ATR-FTIR提供了生物液体样品中生物成分的重要信息,图5给出了血清样本光谱的波段分布。红外生物光谱分布在两个区域:从2600cm-1到3800cm-1的高波数区域,以及由双键拉伸和指纹区组成的2000cm-1到500cm-1的低波数区域。低波数区域提供具鉴别性的数据,也是Z常用于诊断的区域7。

图5 人类血清白蛋白的红外光谱波段分布
结论
本文通过血清样本的生物指纹图谱测试,表明IR5对生物液体分析的高灵敏度。IR5傅里叶变换红外光谱仪配备加热ATR附件,克服了样品含水的问题。使用加热ATR附件,在不降低光谱质量的情况下,使光谱采集所需的干燥时间大大缩短。

参考文献
1.T. Soares Martins et al., “Potential of FTIR Spectroscopy Applied to Exosomes for Alzheimer’s Disease Discrimination: A Pilot Study,” J. Alzheimer’s Dis., vol. 74, no. 1, pp. 391–405, 2020.2.L. J. Pabico et al., “Diagnostic Efficiency of Serum-Based Infrared Spectroscopy in Detecting Breast Cancer: A Meta-Analysis,” Lab. Med., vol. 54, no. 1, pp. 98–105, 2023.3.S. Guo et al., “Fast and Deep Diagnosis Using Blood-Based ATR-FTIR Spectroscopy for Digestive Tract Cancers,” Biomolecules, vol. 12, no. 12, pp. 1–15, 2022.4.S. Roy et al., “Spectroscopy goes viral: Diagnosis of hepatitis B and C virus infection from human sera using ATR-FTIR spectroscopy,” Clin. Spectrosc., vol. 1, p. 100001, 2019.5.K. Naseer et al., “ATR-FTIR spectroscopy as the future of diagnostics: a systematic review of the approach using bio-fluids,” Appl. Spectrosc. Rev., vol. 56, no. 2, pp. 85–97, 2021.6.I. Kokot et al., “ATR-IR Spectroscopy Application to Diagnostic Screening of Advanced Endometriosis,” Oxid. Med. Cell. Longev., vol. 2022, 2022.7.A. Rohman et al., “The use of FTIR and Raman spectroscopy in combination with chemometrics for analysis of biomolecules in biomedical fluids: A review,” Biomed. Spectrosc. Imaging, vol. 8, no. 3–4, pp. 55–71, 2019.



天美仪拓实验室设备(上海)有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒