| 行业应用: | 生物产业 综合 |

荧光成像技术在生命科学基础研究中具有广泛应用,并在生物医学应用等领域展现出良好的应用前景。近年来爆炸式增长的临床前和临床试验项目足以体现生物医学荧光成像的重要性。相比于可见光,近红外荧光(NIR, 700-1700 nm)成像具有更强的光学组织穿透能力和更低的生物自发背景荧光干扰,因而能够提供更高的活体成像对比度,实现更灵敏、更准确的活体检测。近年来,复旦大学化学系张凡教授课题组在提高荧光成像对比度、实现深层组织精确荧光成像方面做出了许多贡献,例如,开发长波长的近红外二区稀土离子-分子配合物(Nat. Mater. , 2021, 20, 1571.)、实现近红外二区长余辉活体荧光成像(Nat. Nanotechnol. , 2021, 16, 1011)、近红外二区生物荧光成像(Nat. Commun., 2020, 11, 4192)、近红外二区荧光寿命活体成像(Nat. Nanotechnol., 2018, 13, 941)等。2023年1月,Nature Reviews Bioengineering杂志正式在线发表了复旦大学化学系张凡教授研究团队综述文章“Near-infrared luminescence high-contrast in vivo biomedical imaging” (图1)。以提高活体荧光成像对比度为主线,该综述系统回顾了近红外荧光成像技术在生物医学应用领域发展过程中面临的问题并总结了相应的解决思路与领域发展现状。
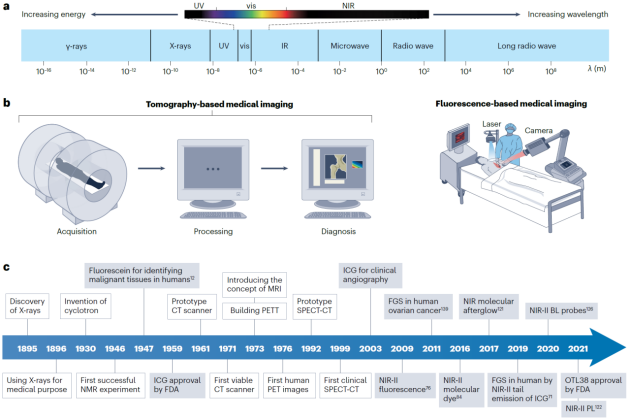
图1. 临床医学影像与荧光成像技术的发展
01 荧光成像技术面临的挑战
荧光成像是生物医学检测模式中Z 简便且具有灵活性的手段,荧光染料的快速发展也促进了多通道复合信号的快速实时检测,使其在生物医学应用中更具有吸引力。近红外活体荧光成像技术近年来发展迅速,但仍面临着多种问题,其真正应用于临床影像和检测的实例并不多。这些问题主要来源于荧光或荧光分子与生物组织的相互作用,导致荧光成像对比度降低。生物组织并不透明,荧光在穿透生物组织过程中与组织和细胞相互作用,发生光子反射、吸收、散射等过程,造成荧光信号的衰减(图2)。组织对荧光尤其是波长为400-700 nm的可见光有明显的削弱作用,并且这一作用是双向的,即激发光和发射光都会在组织中衰减。于此同时,生物组织有含有发色团的生物大分子组成,这些生物大分子在受激发光照射时,通常会产生荧光发射,称为自发荧光,由此造成荧光成像的背景干扰(图2)。另一方面,荧光成像对比度也取决于荧光探针在目标组织的靶向和富集效率。人体具有非常完善的免疫防护机制能够清除注射的外源物质。尽管已有许多研究已经报导利用特殊的配体修饰可以减少探针表面的蛋白吸附,从而减少被免疫系统识别清除。然而,配体修饰方法不能完全避免宿主清除,大多数的探针依然能够被单核巨噬系统识别和捕获。此外,人体不同的器官各自具有特殊的微观结构,对各种具有不同的理化性质探针(尤其是纳米探针)具有选择通过性。荧光成像技术在临床应用受限很大程度上也归因于目前所批准的探针分子在活体中靶向效率欠佳(图3)。
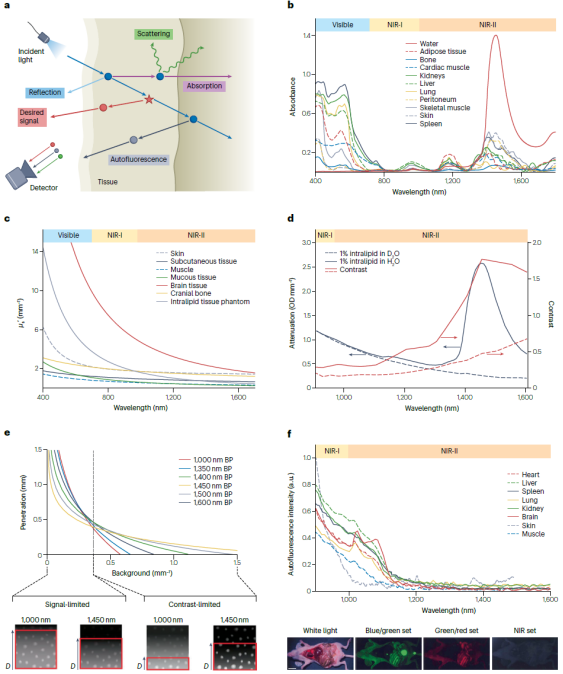
图2. 荧光在组织中的衰减与自发荧光
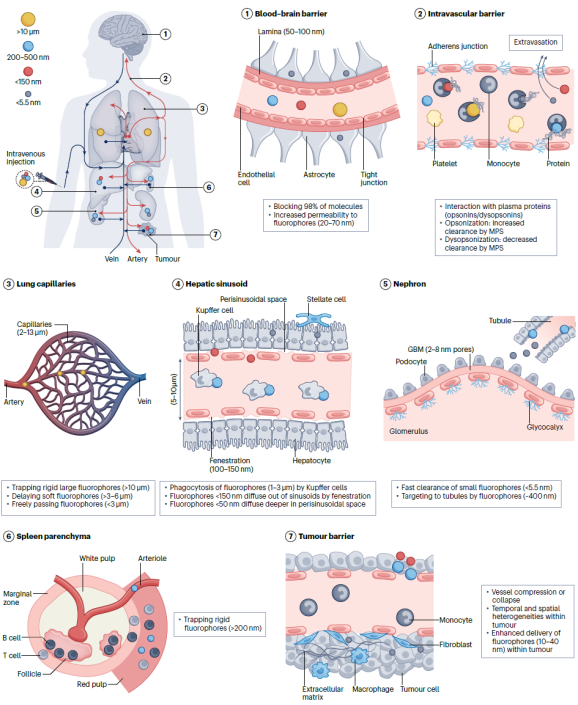
图3. 注射荧光探针在活体中的运输屏障
1.优化荧光探针的光学性能
荧光波长
活体成像的荧光信号实际是从组织内部产生而非机体表面,根据成像位置的不同,荧光探针通常聚集在组织内部距离表面深度从微米到厘米不等。平均自由光程(Transport Mean Free Path,TMFP)描述了光子在组织中沿直线传播的距离,荧光在组织中的极限穿透深度可以由TMFP表述,超过TMFP的荧成像会导致图像对比度低并且信号读出不准确。近红外光(NIR, 700-1700 nm)由于组织吸收和散射低,相比可见光,具有更深的穿透深度。在相同的生物组织中,可见光穿透深度仅能达到微米级,而近红外光则可以达到毫米甚至厘米级。此外,由于生物组织在近红外窗口的自发荧光强度显著降低,因此,近红外窗口的荧光成像的背景更低,能够实现更高的对比度。尤其是近红外第二窗口(NIR-II, 1000-1700 nm)成像,可以实现迄今Z 高的荧光成像对比度(图4)。近年来,多种具有良好光学性能的NIR-II纳米荧光探针被设计并用于活体成像。例如,单壁碳纳米管(SWCNTs)、量子点(QDs)、镧系下转换纳米颗粒(LnNPs)和金纳米颗粒(AuNPs)等。然而,无机纳米颗粒由于不可生物降解,在人体内的长期毒性仍然未知。为了解决这一安全顾虑,研究者们开发了具有NIR-II发射的有机分子荧光探针(图1.11)。尽管分子探针还不能取得与NIR-II无机纳米颗粒相媲美的成像效果,但已开发的NIR-II有机荧光分子,如CH1055、FD1080和LZ1105已经在小鼠活体成像中展现出了比临床批准的ICG更好的荧光成像效果。
荧光亮度
亮度较低的荧光探针使用时需要更高的注射剂量、更大的激发功率或更长的曝光时间,因而可能会导致更大的毒副作用、产生超出人体耐受范围的热负荷或丢失成像过程中的动态信息。反之,亮度高的荧光探针具有更深的成像穿透深度,并且低激发光功率有助于削弱背景信号,能实现更高的成像对比度对于无机纳米颗粒,由于发光机理不同,无机纳米材料的亮度通常由颗粒的尺寸、掺杂剂、晶相、配体或刚性等因素决定。在纳米结构中引入核壳结构来减少水分子对荧光的淬灭作用是一种对大多数纳米颗粒通用的亮度提升策略。与有机荧光分子相比,无机纳米材料通常有较高的量子产率和优越的光稳定性。但是对于NIR有机分子探针,由于其长波长通常来源于分子内较大的共轭平面结构,这也导致了分子在水溶液中稳定性差、亮度低等问题。一方面,可以通过在分子中引入空间位阻来减少分子间的相互作用以提高荧光分子的亮度。例如,在分子侧链中通过共价键引入基团增大荧光团位阻,或者利用蛋白质包裹疏水的荧光团,通过超分子相互作用形成稳定的蛋白质-荧光分子复合物。
荧光斯托克斯位移
斯托克斯位移的存在决定了荧光成像技术中探针内在的二次滤波效应,有助于实现更高的成像对比度。探针具有较小的斯托克斯位移会导致发射光子被分子重吸收并,由此导致分子荧光的自猝灭。此外,由于激发光谱和发射光谱的重叠会导致有激发光和散射光引起的相关检测误差,降低检测灵敏度和成像对比度。探针具有较大的斯托克斯位移可以避免荧光串扰,简化信号区分,更易实现多色成像。在对深部组织进行荧光成像时,斯托克斯位移的作用尤其明显。病变深度的变化对斯托克斯位移小的荧光探针有较大的影响。对于浅表组织的荧光成像,斯托克斯偏小(< 50 nm)但亮度高的荧光团可以展现更高的成像对比度。相反,对全身或深层组织成像时,斯托克斯位移较大的探针(>100 nm)更具有优势。这主要是由于激发光在穿透厚组织时产生的背景荧光,小斯托克斯位移的探针由于内在滤波效果差,产生的反射和散射光子容易造成强烈的干扰信号。
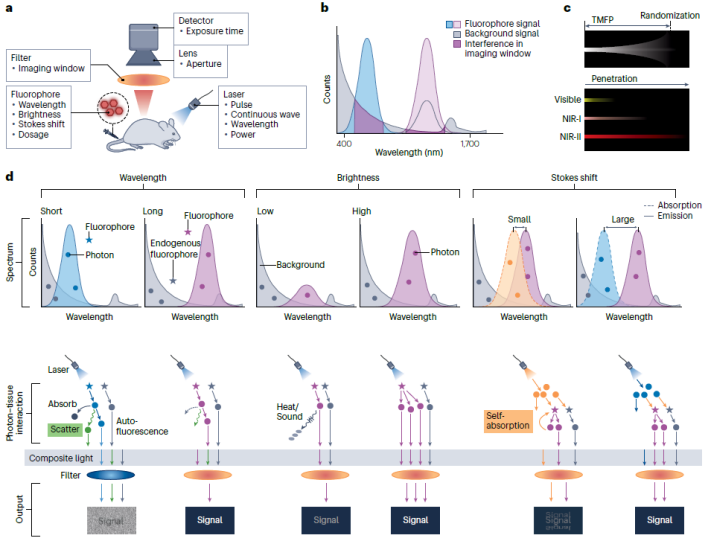
图4. 优化荧光探针性能
2.降低活体组织荧光背景
传统的荧光成像技术需要实时的光激发,不可避免地导致了激发光散射和组织自发荧光。当滤光片能有效地滤过散射光,则散射光对成像对比度的干扰很小,但实际应用过程中光学元件滤光效率难以达到100%。尽管组织散射和自发荧光在近红外窗口的影响相比可见区有明显衰减,但它们对成像对比度和检测灵敏度的影响不可忽视,因此在生物医学应用中需要加以考虑和应对。近年来发展的无背景成像技术有效降低了成像背景干扰问题。这些技术大体上可以分为以下三类(图5):
延迟荧光成像
通过调制检测器和激光脉冲可以在去除激光光源后获得探针的部分荧光信号。这种策略也被称为时间门控成像技术。该技术成像对比度与荧光信号采集时间窗口有关,并随着延迟时间的延长而增加,当组织自发荧光完全衰减后可以实现 Z 大成像对比度。因此,延迟荧光成像的对比度取决于荧光探针与组织自发荧光之间的寿命差距,探针的荧光寿命越长,越容易实现高对比度成像。延迟荧光成像技术中引入约1 μs的延迟时间,就能够完全消除组织的近红外自发荧光。一种极限长寿命发光现象,长余辉发光(PL),指在停止激发后荧光可以持续数分钟或数小时的光学现象。长余辉成像与时间门控荧光成像在方法上的区别在于前者不需要调制检测器和激发脉冲。应用近红外PL活体成像相比于传统基于实时激发的近红外荧光成像方法,其成像对比度可以提高几十至几百倍。
自发光成像
生物发光(BL)存在于鱼类、昆虫、藻类和植物中,是酶催化氧化发光前驱体并释放光子的现象。由于不需要激发光,成像背景几乎为零,已被广泛应用于细胞作用、蛋白质相互作用、感染和肿瘤等研究领域。天然的生物发光底物荧光波长在可见区,这一波段的荧光容易被组织吸收和散射,所以穿透深度有限。因此,改造生物发光底物使之波长红移到NIR窗口,增强生物发光的穿透深度,对于活体成像的实际应用具有重要意义。另一方面,化学发光(CL)成像技术应用与生物发光类似。化学发光是化学反应过程中产生的荧光发射现象。化学发光由于独特的发光机制(氧化还原反应),可以用于检测病变组织中过表达的活性氧(ROS)、活性氮(RNS)。与传统的激发荧光成像不同,化学发光可以在检测病灶原位生成,因而不受激发光漂白和背景干扰影响,具有比传统荧光成像更高的检测灵敏度和成像对比度。将自发光(BL、CL)底物与NI荧光分子混合包裹成胶束,使之形成生物荧光共振能量转移(BRET),将生物发光波长延长到近红外区可以进一步提高荧光穿透深度和成像对比度。
使用其他激发光源
生物自发荧光来源于短波长光子与生物组织的相互作用。利用激光器之外的其他特殊光源可以减少这一现象从而降低生物背景荧光。例如,X-射线可以自由地穿透生物组织而不会引起散射和组织自发荧光。利用X-射线激发荧光探针使之发出近红外荧光进行生物检测,可以同时实现更深的组织穿透深度和更低的荧光背景信号。除X-射线外,切伦科夫辐射(CR)也可作为激发源用作荧光成像。PET成像用到的核素,例如18F、64Cu、68Ga、89Zr、90Y能够发射β-粒子并发射出蓝色的光,即切伦科夫光。但由于切伦科夫光波长短,直接应用于荧光成像时组织穿透能力差,且在组织中造成了自发荧光背景,很难用于实际活体检测或手术导航。因此利用切伦科夫共振能量转移(CeRET)策略,将核素与近红外荧光探针结合,将切伦科夫光的波长延伸到近红外区以提高其组织穿透能力。在这种共振能量转移系统中,切伦科夫光扮演了原位激发的角色,相比于利用外置光源激发,这种原位激发策略不存在入射光衰减的影响。此外,由于荧光检测器使用更灵活、更经济,开发便携式的荧光检测器代替PET成像仪器能够使疾病筛查更简便、成本更低。
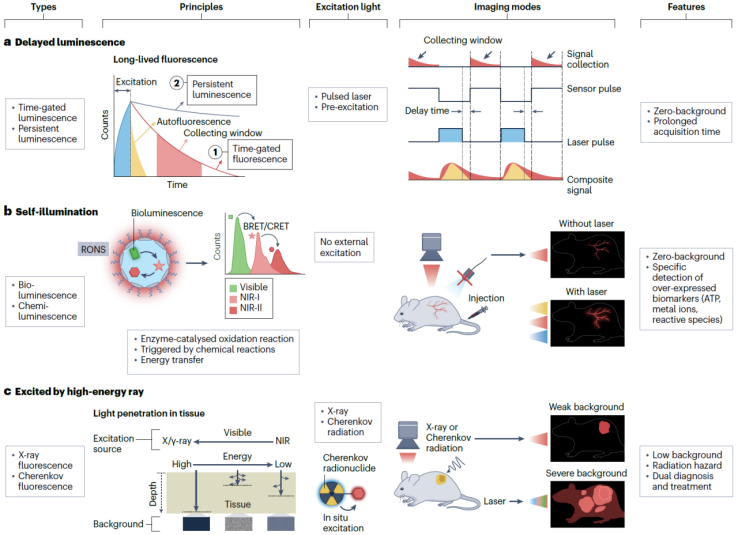
图5. 无背景荧光成像技术
3.局部组织成像
静脉注射造影剂是体内发光成像Z 常用的给药 方法。但大多数探针可能会被免疫系统识别捕获,造成严重的背景信号并降低成像对比度。
调节探针的生物分布
带有特定靶向配体的探针可以靶向到细胞表面的受体,特异性配体如叶酸、葡萄糖、前列腺特异性膜抗原、多肽、适配体、抗体或蛋白等常被修饰在分子或纳米探针的表面以实现肿瘤靶向。除了利用靶向配体修饰探针外,还可以通过改变探针理化性质来调控探针在活体中的代谢和分布(图6)。例如,对于无机纳米探针,超小纳米颗粒(<5.5 nm)可以快速被肾脏清除,因此可以用来评估肾小球滤过率。通过改变有机分子探针的取代基团可以改变其在活体中的代谢与分布,从而调控组织中的荧光信号分布及成像对比度。例如,设计分子结构使其特异性分布在小鼠的甲状腺、甲状旁腺、外周神经纤维、肾脏、肾上腺、脑垂体、骨头、胰 腺、淋巴结和肿瘤等。
针对局部组织进行特殊处理
对成像组织进行特殊预处理其目的一为提高荧光探针在局部成像组织中的富集浓度。一方面,由于单核吞噬细胞系统对外源药物的清除有一个剂量阈值,超过这一阈值上限以外的颗粒能够避免被Kupffer细胞捕获。目前有多种材料包括碳纳米颗粒(20-50 nm)、硫酸葡聚糖、氯化钆和氯膦酸脂质体等,被证明能够用于预注射以使MPS达到饱和状态,从而阻断MPS对荧光探针的捕获,提高药物的被动靶向效率。另一方面,另外,也可以利用超声和微气泡形成的刺激扩大血管内皮细胞间隙,增加脑血管或肿瘤血管的通透性以提高探针靶向效率。其目的二为降低局部组织的荧光背景。光学清除技术(又称光学透明技术)可以去除组织中的脂质和水分子等,使组织吸收和散射大大减少,同时辅助以匹配组织与成像环境的折射率,能够降低组织的背景荧光并提高光的穿透深度和成像对比度。在活体中实现光学透明需要有高度安全性和生物相容性,因此透明过程必须具有可逆性。活体中使用的清除剂仅局限于生物相容性好的水溶液,如甘油、乙二醇、醋酸、糖、聚乙二醇和丙二醇等。
可激活型荧光探针
激活型探针的设计需要必须包含能够响应外环境刺激的结构,能在特定的生物标志物如金属离子、酶、氧化还原环境或其他生物分子存在的条件下发生反应和结构变化,并体现出荧光强度、波长或寿命等方面的显著改变。由于探针通常也会在正常组织中滞留并造成背景信号,为了提高成像对比度,需要等待探针从正常组织中被清除之后才能更好地显示病变组织和健康组织之间的区别。相比之下,可激活型荧光探针仅在含有特异的或过表达的生物标志物的病变组织中显示信号变化。目前研究较多的是基于荧光发射强度变化的激活型荧光探针,例如,利用肿瘤微环境的偏酸性条件来激活荧光探针,实现荧光从“关”到“开”的转变。这类荧光探针通常在血液中处于淬灭状态,但在到达肿瘤部位后发生分解或结构变化,同时伴随着荧光强度的显著提升。临床上目前也正在尝试利用肿瘤部位的酸激活策略来提高成像对比度。
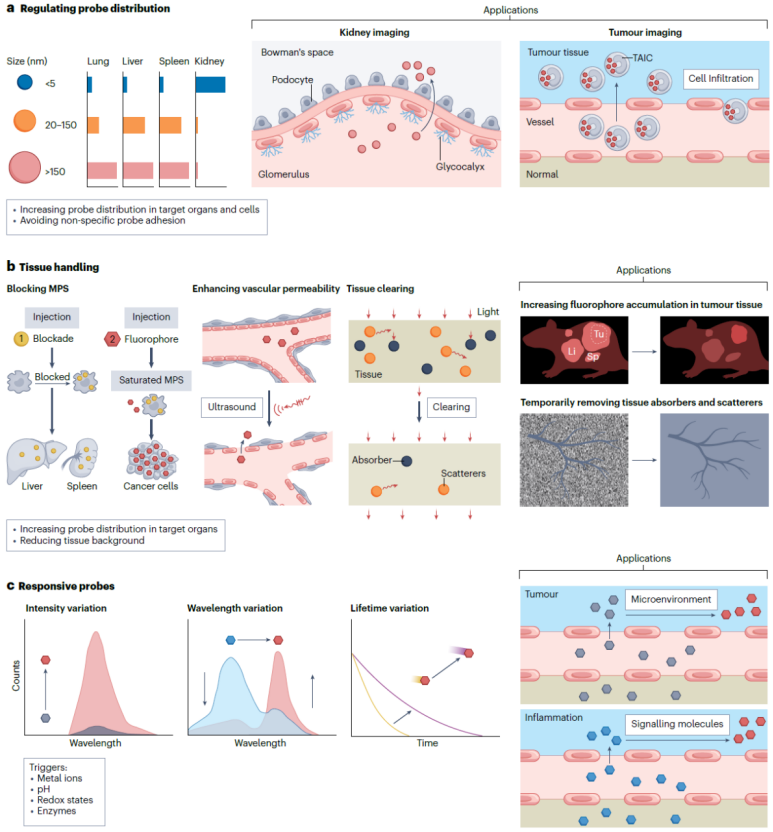
图6. 局部组织成像
03 总结与展望
目前近红外荧光成像的临床试验主要聚焦在具有靶向性的NIR-I染料,如用ICG和IRDye 800CW标记的生物分子等。NIR-II窗口的发现促进了荧光探针的进一步发展,在优化探针结构的同时,检测器的发展也需要齐头并进。此外,随着生物工程与基因编码技术的进步,发现并解码近红外自发光蛋白或能推动高对比度荧光成像与光遗传学的快发展。
张凡课题组博士生陈莹为论文第 一作者。该工作得到了复旦大学化学系、复旦大学先进材料实验室、聚合物分子工程国家重 点实验室、上海市分子催化与功能材料重 点实验室、国家重 点研发项目、上海市科学技术委员会重 点基础研究项目。

天美仪拓实验室设备(上海)有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒