
立即扫码咨询
联系方式:400-855-8699转8030
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
植物细胞壁是保护植物细胞免受病原体入侵的第一道屏障,由纤维素、木质素等在内的多糖网络组成。[1, 2]而植物细胞壁中的多糖提供了大量潜在的可发酵糖,这些糖可能成为可再生生物燃料和化学品的来源。[3]多糖作为膳食纤维的重要组成部分,已被证明对人类和动物的健康十分有益。[4, 5]分析植物细胞壁多糖的含量、分布和它们之间的相互作用有助于带来更多的洞察力,可进一步了解植物细胞壁的生物学功能及其潜在应用。
为了在微观尺度上以非破坏性的方式揭示植物组织的组成,拉曼成像技术已成为一种重要的工具。拉曼成像是拉曼光谱技术的新发展,结合拉曼光谱检测系统和光学显微镜,将简单的单点分析拓展到对一定范围内样品进行综合分析,以图像呈现样品的化学组分空间分布及表面物理化学性质等信息。[6]在本应用中,爱丁堡仪器公司的RM5显微拉曼光谱仪被用来分析植物细胞壁各组分的分布及含量。
材料与方法
使用配备532 nm激光和600 gr/mm光栅的RM5显微拉曼光谱仪研究植物细胞壁各组分的分布及含量。由于植物样品非常易损坏,因此必须小心使用拉曼光谱仪。RM5具有通过Ramacle® 软件控制的全自动激光衰减器,使用户能够确保样品不会受到激光损坏。

图1 爱丁堡仪器RM5显微拉曼光谱仪
结果与讨论
拉曼成像技术中每个像素都对应于拉曼光谱,这是一种“分子指纹”,通过对所提取的光谱进行分析,可以确定特定组分的存在,并显示出它们在样品中的位置和分布。RM5 采用的是真共焦技术的设计,内置多档连续可调的机械针孔,具备高共焦模式和高通量模式,为了降低背景噪声的影响和提高成像的共焦度,实验中选择高共焦模式,共焦针孔选择40μm,同时与机械狭缝联用,实现zui大程度抑制背景干扰在生物和生命科学中,该技术用于组织、整个细胞或其部分的成像,而不需要染料染色。以植物细胞壁为例,其特征拉曼峰主要对应于细胞壁中纤维素与木质素官能团。在图2(C)和图3(C)中可以看出,由于木质素具有苯环结构,光谱在1600 cm-1 附近出现强烈振动峰; 典型的纤维素组分特征峰位于2889 cm-1附近,来自—CH和—CH2的伸缩振动。[7-9]若对光谱中1600 cm-1和2889 cm-1的特征峰进行成像,可分别获得木质素、纤维素组分含量分布图。

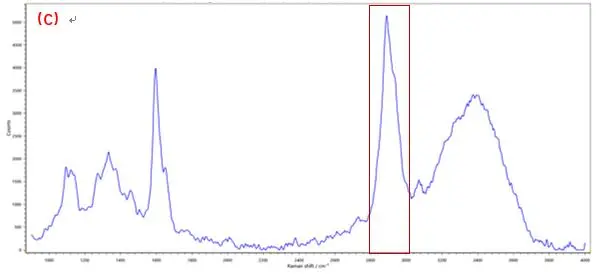
图2 植物细胞木质素成像分布分析,A.白光图;B.成像图;C.光谱图(成像区域70μm x 70μm, 步进为0.7μm)
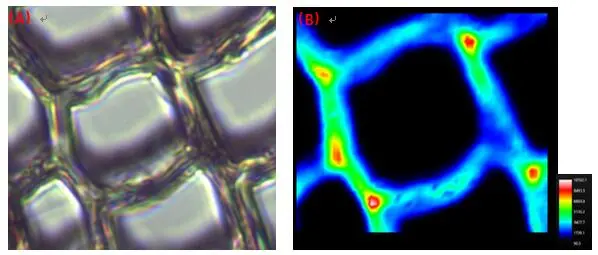
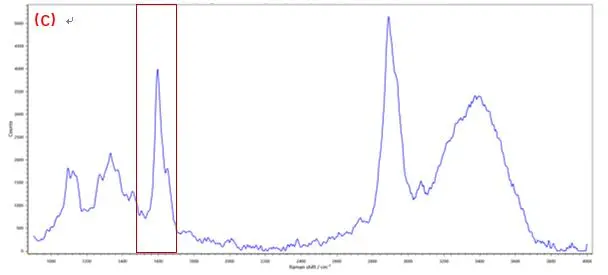
图3 植物细胞纤维素素成像分布分析,A.白光图;B.成像图;C.光谱图(成像区域70μm x 70μm, 步进为0.7μm)
成像图分析了70x70μm的植物细胞样品,基于Ramacle软件中的FastMap功能,在普通的CCD检测器中可使样品的单张光谱获取时间缩短至3.7ms。图2中(A)与(B)分别显示了植物细胞的白光图与木质素在植物细胞壁中的拉曼成像图,可更清楚的看到两组分在其中的分布与含量。由图2(B)中可看出,在3-4个细胞之间所存在的共有区域——细胞角隅处的拉曼信号zui强,表明在该区域的木质素浓度Z高。而纤维素是在两细胞之间的区域含量较高(图3(B))。结合两图可知,植物细胞壁中木质素的整体含量大于纤维素,而且两者的分布相互独立。该应用也证实了拉曼光谱成像技术在植物细胞壁化学组分研究方面的潜力。
结论
在本应用中,强调了拉曼成像技术可用于研究植物细胞壁内木质素、纤维素的分布和含量。RM5显微拉曼光谱仪高的空间和光谱分辨率可进行高质量的成像分析,RM5使用自动样品台进行拉曼谱图的扫描,电动样品台能够实现X、Y和Z方向上精确移动控制,是植物细胞学非破坏研究的理想工具。
参考文献
[1] M. C. McCann, N. C. Carpita, Curr. Opin. Plant Biol. 2008, 11, 314.
[2] M. Ochoa-Villarreal, E. Aispuro-Hernández, I. Vargas Arispuro, M. A. Martínez-Téllez, Polymer. 2012, 4, 63.
[3] M. Pauly, K. Keegstra, Plant J. 2008, 54, 559.
[4] N. M. Koropatkin, E. A. Cameron, E. C. Martens, Nat. Rev. Microbiol. 2012, 10, 323.
[5] H. M. Collins, R. A. Burton, D. L. Topping, M. L. Liao, A. Bacic, G. B. Fincher, Cereal Chem. 2010, 87, 272.
[6] Gierlinger N, Schwanninger M. Spectroscopy. 2007, 21: 69.
[7] Wiley J H, Atalla R H. Carbohydr. Res., 1987, 160: 113.
[8] Agarwal U P. Ralph S A. Appl., Spectroscopy. 1997, 51: 1648.
[9] Gierlinger N, Schwanninger M, Plant Physiol., 2006, 140: 1246.
相关产品
全部评论(0条)
推荐方案
参与评论
登录后参与评论