研究HUVEC的iPSC多能性和毛细血管网形成的高级3D模型
2021-10-091408用于研究HUVEC的iPSC多能性和毛细血管网络形成的
高级体外3D模型
Josefin Blell,理学硕士,Shubhankar Nath,博士,
Christen Boyer,博士和 Itedale Namro Redwan,博士
CELLINK,瑞典哥德堡
摘要
将人脐静脉内皮细胞(HUVECs)和人真pi成纤维细胞(HDFs)共培养和诱导多能干细胞(iPSCs)单培养 分别包埋于选定的生物材料中7d。利用免疫荧光成像将这些三维培养系统的细胞标记与二维培养进行了比较,并证明了使用细胞相关材料的重要性。HUVEC与HDF共培养的时间是获得复杂结构的重要因素。在3D 中延长培养时间导致观察到促血管生成结构,这一现象只在3D中观察到。与2D相比,iPSCs在3D培养时形成团簇,细胞组装重塑,形成环形结构,并表达多能性标记OCT4和NANOG。iPSCs可以在3D培养中保持其 多能性,这使得科学家可以设计更先进的实验,在这种实验中,干细胞可以在3D嵌入后进行分化。
介绍
由于整个 3D 矩阵中细胞自组装和重组的差异,3D 生物打印和共培养类器官Z近受到了广泛关注。 单一培养类器官倾向于在 3D 中聚集以Z大化粘附并Z小化能量,而共培养则根据细胞间粘附的差异进行重组
(Foty,2005 年;Napolitano,2007 年)。 一般来说,不同的细胞类型在细胞重组过程中也会相互显着影响。 例如,单独的内皮祖细胞不会形成血管组织,但当与人真pi成纤维细胞(HDF) 或平滑肌细胞类型共培养时,血管内皮管可以在多孔生物材料或生物墨水中形成 (Unger, 2007)。 一项使用人脐静脉内皮细胞(HUVEC) 的研究表明,这些细胞在没有成纤维细胞的情况下无法形成内皮细胞腔,这凸显了共培养系统的重要性(Newman,2011)。
在研究过程中,对HUVEC培养的相关标记进行了分析。分化簇31(CD31)是一种内皮细胞特异性标记物,用于二维和三维培养中监测内皮细胞的分化、自组装和血管生成。CD31在HUVECs表面表达,并已知在类有机分子内自组织(Wu,2004)。occludens-1(ZO-1)是一种细胞质蛋白,作为支架分子,是上皮细胞和内皮细胞 紧密连接的组成部分。ZO-1氨基末端能与claudins和α-catenin/cadherins结合,羧基末端能与肌动蛋白细胞骨架相互作用(Itoh,1997)。表明在上皮细胞中,ZO-1是三维形成管腔所必需的。在排列的HUVEC三维培养中,ZO-1在紧密连接的功能性内皮形成中发挥重要作用(Kang,2018)。
多能性标记OCT4、SOX2和NANOG在维持胚胎干细胞和诱导多能性干细胞(iPSCs)的稳定中起着关键作用。证据表明,在分化和发育过程中,它们表达模式的改变控制着细胞的命运(Wang,2012)。例如,OCT4 调节BMP4通路并与之相互作用,以指定不同的发育命运。高水平的OCT4能在缺乏BMP4的情况下自我更新,但在存在BMP4的情况下指定中胚层。低水平的OCT4在没有BMP4的情况下诱导胚胎外胚层分化,但在 有BMP4的情况下明确胚胎外谱系。SOX2抑制中胚层分化, 而NANOG抑制胚胎外胚层分化(Rizzino, 2016)。这表明了在3D基质中嵌入iPSCs或在2D中培养时保持这些多能性标记的重要性。
材料和方法
细胞制备
将HUVECs培养在大血管内皮细胞培养基中,添加生长补品(Cellworks,ZHM-2953),并添加0.1%庆大霉素/ 两性霉素抗生素(Gibco,R-015-10)。新生儿HDF在成纤维细胞生长培养基(促进细胞,C-23010)中培养。iPSCs按Celllatis's培养方案培养。iPSCs在Synthemax II-SC基质(Corning,3535)涂层上培养,并用Versene溶液(Gibco,15040-033)分离。培养基为Cellartis DEF-CS 500无Xeno培养基(Takara Bio,Y30045),添加添加剂(Takara Bio,Y30042)和1%庆大霉素/两性霉素(Gibco,R-015-10)。
生物墨水的制备与生物打印
对于HUVEC-HDF生物打印,将GFP标记的HUVEC细胞以1:1的比例与HDFs混合,并与bioink、Matrigel Matrix(Corning,354234)或GelMA(CELLINK,IK305102)混合,以200万细胞/ml的比例添加纤维连接蛋白, bioink与细胞的比例为9:1。bioink和细胞在两个注射器之间混合,然后通过连接的22g喷嘴(CELLINK, NZ4220005001)分配。Gelma基样品在3 cm处光交联15秒,Matrigel基样品在37℃下热交联20分钟后加入介质。在每周更换3次的HUVECs培养基中培养。
对于iPSCs生物打印,细胞以100万个细胞/ml的比例在两个注射器之间以10:1的比例bioink(Matrigel或
GelMA , 补 充 层 粘 连 蛋 白 521(GelMA+LN521)) 与 细 胞 ( V/V ) 混 合 , 并 通 过 20g 喷 嘴
(CELLINK,NZ4200005001)分配。GelMA光交联5~10秒,Matrigel热交联。培养基每天更换。
一般情况下,所有样品在未经处理的96孔板(VWR,7342781)中以液滴形式生物打印,使用
BIO X(CELLINK,D16110020717)和在100微升相应生长培养基存在下培养所有的光交联都是在405nm的光模块上进行的。2D细胞在腔室细胞上培养
培养幻灯片(Falcon,354108)。所有培养物均保持在37°C和5%CO2下。分别于3d和2d培养5~14d和3~4d, 用免疫组织化学(IHC)分析不同标记物的表达。
免疫染色
用4%多聚甲醛(CaCl2 50 mM)固定5~6小时,然后用乙醇和二甲苯脱水。在用切片机切片至5μm厚之前,用石蜡浸润和包埋这些结构。切片在显微镜载玻片上固定,并在二甲苯和乙醇中分离。用抗原回收缓 冲液煮沸制备抗体染色样品,然后用封闭液处理。2D细胞固定1~3h,用0.5%Triton-X100渗透,用封闭液 处理。将一抗溶液加入所有玻片中,在4℃下孵育过夜。切片经PBS洗涤后,在室温下用二次抗体处理1h。细胞核用NucBlue固定细胞ReadyProbes试剂(Invitrogen,R37606)反染。将盖片安装在载玻片上,并附上氟蒙特-G(Invitrogen,00-4958-02)。用荧光共聚焦显微镜(ZEISS LSM710 NLO)在相同的采集参数下分析次级抗体的定位。
结果和讨论
HUVEC-HDF共培养:为了确定不同基质对HUVECs和HDF共培养的影响,首先用荧光显微镜观察其形态差异。生长在Matrigel和GelMA纤维连接蛋白中的细胞形成致密的网络,表现为细长的表型,而2D细胞表现为 细长较少而圆形较多的形态(图1)。此外,二维图像显示GFP-HUVECs在少数上皮细胞中呈簇状分布。
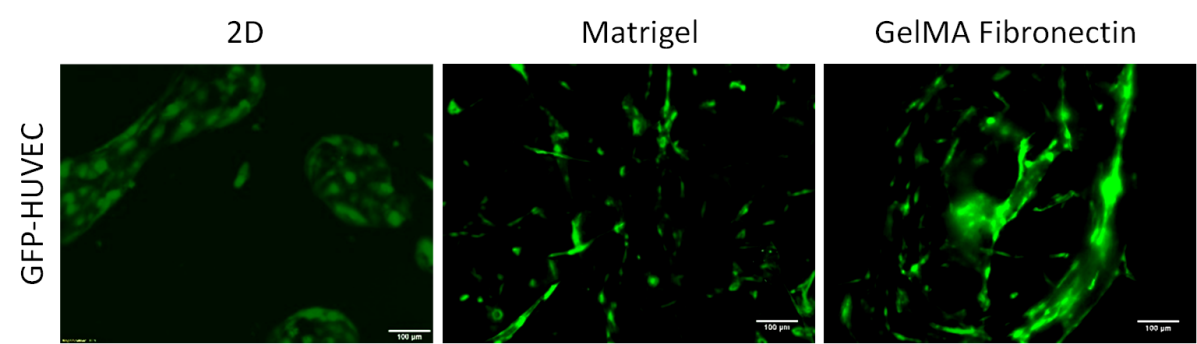
图1.GFP 标记的 HUVEC(绿色)在 2D 单层(第 3 天)和Matrigel(第 7 天)和 GelMA 纤连蛋白(第 14 天)上的 3D 培养中与 HDF 共培养。 比例尺= 100 µm。
ZO-1染色:除了细胞形态外,紧密连接在内皮屏障功能的调节中起着至关重要的作用。为此,对紧密连接相关蛋白ZO-1进行免疫染色,分析其在2D和不同3D基质中的细胞分布。如图2所示, 在第15 天,在GelMA纤维连接蛋白Sam-ples 中检测到高水平的ZO-1。在GelMA 纤维-果胶样品中也观察到几个芽, 表明这些细胞具有形成毛细血管样结构的能力。有趣的是,ZO-1二维染色不仅局限于HUVECs , 也可在HDFs中检测到, 提示一个含有合适ECM成分的三维环境对维持不同细胞系蛋白质的结构和时空表达是必要的。
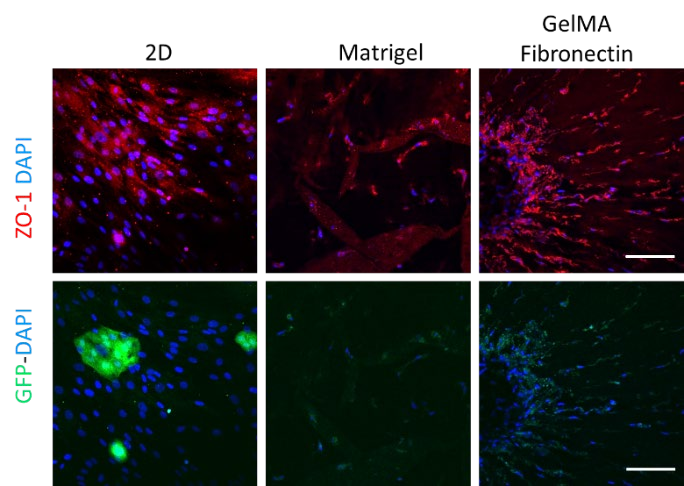
图2.GFP-HUVEC和HDF共培养2d(第3天)和Matrigel
(第8天)和GelMA纤维连接蛋白(第15天)分别用ZO- 1(红色)和DAPI(蓝色)染色。比例尺=100μm。
CD31染色:为进一步鉴定共培养物,对特异性内皮标记物CD31进行免疫荧光染色。毫不奇怪,CD31的表达仅限于2D 和 GelMA 纤 维 连 接 蛋 白 第 15 天 的HUVECs,这可以通过重叠表达GFP和CD31/DAPI 的HUVECs 图像面板显示(图3)。不幸的是,在atrigel第8天培养中检测到非常低水平的CD31,这可以由GFP信号所示的视野中HUVECs细胞的非常低数量或缺乏来解释(图3)。
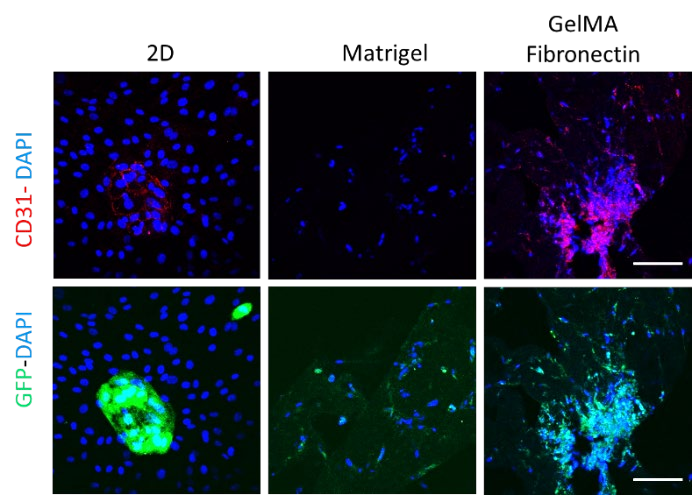
图3.GFP-HUVEC与HDF共培养2d(3d)、3d、3d,CD31(红)、DAPI(蓝)染色,Matrigel(8d)、GelMA纤维连 接蛋白(15d)染色。比例尺=100μm。
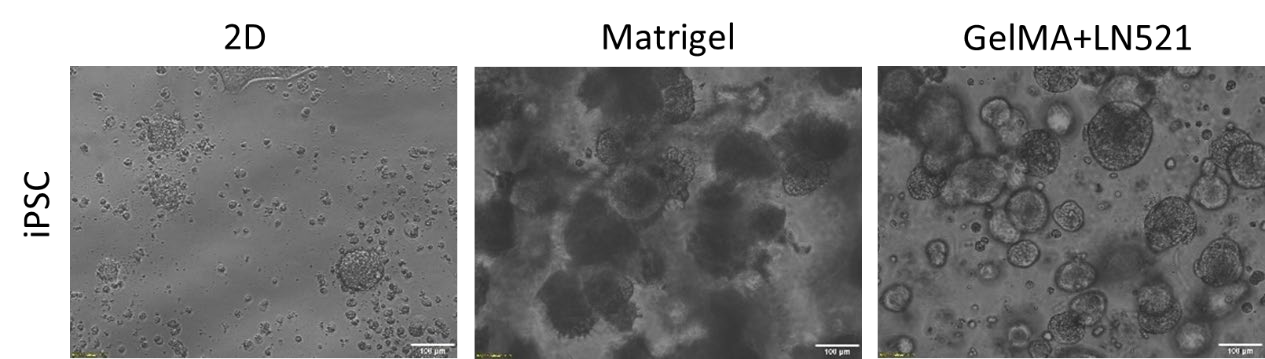
图4.在3DMatrigel或Gelma+LN521中对培养4d后的iPSCs进行2d和7d的亮场图像。比例尺=100μm。
接下来,用亮场显微镜观察生长在2D和3D簇中的iPSC细胞的形态,如图4所示。在Matrigel和Gelma+LN521 中均观察到不同大小的球体。此外,还对三个多能性标记OCT4、NANOG和SOX2的表达进行了评估。
多能性标记物 OCT4 在所有条件下都有不同程度的表达,如图 5(上图)所示。在 2D 中,在细胞簇的周边观察到Z高的信号强度。而在 Matrigel 中,信号强度均匀分布在整个样品上。对于图 5( 中图)中的NANOG 染色样品,观察到非常相似的表达模式。需要更长的曝光时间来可视化图 5(下图)所示的 2D 样品中的 SOX2 表达。除了多能标记物的表达外,还观察到 GelMA+LN521 中细胞簇的环状形态,主要是在Matrigel 中。这些空心簇类似于神经玫瑰花结或早期中胚层结构(Muratore,2014)。然而,需要进一步分析以确认任何潜在的分化,因为iPSC 在观察到细胞聚集的所有条件下都保留了 OCT4 和 NANOG 的表达。这些多能性标记物不是所有分化命运的泛阻遏物,而是每个控制向特定谱系的分化。例如,NANOG 抑制胚胎外胚层分化而对其他谱系几乎没有影响,而SOX2 抑制中内胚层分化(Wang,2012)。转录因子小心翼翼地相互作用以将细胞保持在多能状态,与其他因子相比, 一种因子表达的微小变化可导致分化
(Rizzino,2016 年)。免疫荧光观察到的微小变化不是定量的,但表明即使在嵌入和 3D 生物打印后仍保留了多能性标记,为 3D 生物打印过程后的分化开辟了新的机会。
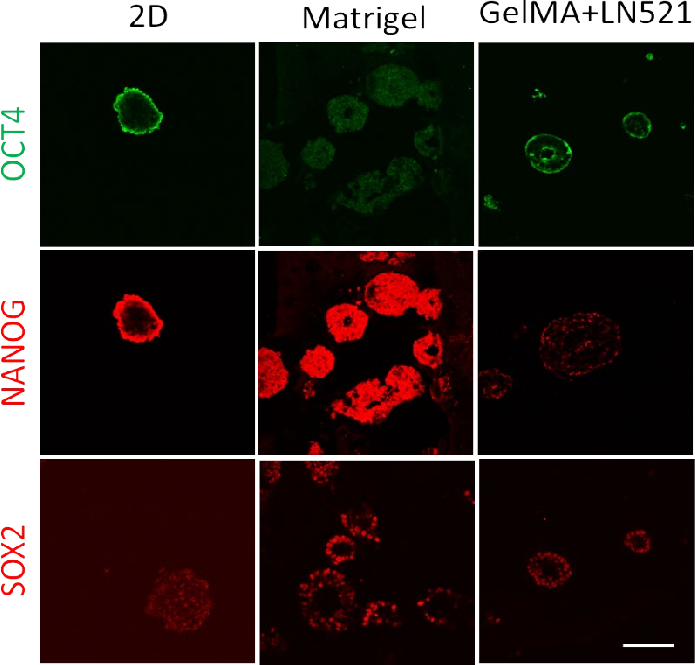
图 5. 2D 培养 4 天和 3D Matrigel 或GelMA+LN521 培养 7 天后 iPSC 中的OCT4、NANOG 和 SOX2 表达。 所有图像均使用相同的采集参数捕获,但SOX2 的 2D 图像已为可视化进行了增强。 比例尺 = 100 µm。
结论和今后的方向
与二维细胞培养相比,3D生物打印显示出多种优势,包括多细胞结构的精确几何排列,可以更好地再现自然的三维人体生理学。细胞根据来自周围细胞和环境的外部信号进行自组装。这一重要现象有助于理解胚 胎发生、血管生成、伤口愈合和肿瘤形成,也可能有助于开发新的生物人工器官血管化药物和途径。这项 研究得出以下结论:
Ø 三维环境对于HUVECS复杂结构的发展和网络形成至关重要。
Ø 三维培养时,iPSCs形成团簇,重塑细胞组装,形成环面状结构。在2D控制中没有观察到类似的iPSCs重排。
Ø 在2D和3D中,iPSCs表达多能性标记OCT4和NANOG,而SOX2在2D中的表达低于3D。
Ø iPSCs可以在3D培养中保持其多能性,这使得科学家可以设计更先进的实验,在3D嵌入后可以进行干细胞分化。
参考文献
1. Foty RA, Steinberg MS. The differential adhesion hypothesis: a direct evaluation. Developmental Biology. 2005; 278(1): 255–263. DOI:10.1016/j.ydbio.2004.11.012.
2. Napolitano AP, Chai P, Dean DM, Morgan JR. Dynamics of the self-assembly of complex cellular aggregates on micromolded nonadhesive hydrogels. Tissue Engineering. 2007; 13(8): 2087–2094. DOI:10.1089/ten.2006.0190.
3. Unger RE, Sartoris A, Peters K, et al. Tissue-like self-assembly in cocultures of endothelial cells and osteoblasts and
the formation of microcapillary-like structures on three-dimensional porous biomaterials. Biomaterials. 2007; 28(27): 3965–3976. DOI:10.1016/j.biomaterials.2007.05.032.
4. Newman AC, Nakatsu MN, Chou W, et al. The requirement for fibroblasts in angiogenesis: Fibroblast-derived matrix proteins are essential for endothelial cell lumen formation. Molecular Biology of the Cell. 2011; 22(20): 3791– 3800. DOI:10.1091/mbc.E11-05-0393.
5. Wu X, Rabkin-Aikawa E, Guleserian KJ, et al. Tissue-engineered microvessels on three-dimensional biodegradable scaffolds using human endothelial progenitor cells. American Journal of Physiology. Heart and Circulatory Physiology. 2004; 287(2): H480–7. DOI:10.1152/ajpheart.01232.2003.
6. Itoh M, Nagafuchi A, Moroi S, Tsukita S. Involvement of ZO-1 in cadherin-based cell adhesion through its direct binding to alpha catenin and actin filaments. The Journal of Cell Biology. 1997; 138(1): 181 – 192. DOI:10.1083/jcb.138.1.181.
7. Kang B, Shin J, Park H-J, et al. High-resolution acoustophoretic 3D cell patterning to construct functional collateral cylindroids for ischemia therapy. Nature Communications. 2018; 9(1): 5402. DOI:10.1038/s41467-018-07823-5.
8. Wang Z, Oron E, Nelson B, et al. Distinct lineage specification roles for NANOG, OCT4, and SOX2 in human embryonic stem cells. Cell Stem Cell. 2012; 10(4): 440–454. DOI:10.1016/j.stem.2012.02.016.
9. Rizzino A, Wuebben EL. Sox2/Oct4: A delicately balanced partnership in pluripotent stem cells and embryogenesis. Biochimica et Biophysica Acta. 2016; 1859(6): 780–791. DOI:10.1016/j.bbagrm.2016.03.006.
10. Muratore CR, Srikanth P, Callahan DG, Young-Pearse TL. Comparison and optimization of hiPSC forebrain cortical differentiation protocols. PLoS One. 2014; 9(8): e105807. DOI:10.1371/journal.pone.0105807.
-
- Cellink 生物3D打印机 INKREDIBLE+
- 品牌:瑟林克
- 型号:INKREDIBLE+

-
- Cellink 生物3D打印机 BIO X
- 品牌:瑟林克
- 型号:BIO X
-
- Cellink BIO X6 3D生物打印机
- 品牌:瑟林克
- 型号:BIO X6

-
- Cellink BIO MDX 3D生物打印机
- 品牌:瑟林克
- 型号:BIO MDX


