类器官串联芯片培养系统--- HUMIMIC
类器官技术平台是一种微流控微生理系统平台,能够维持和培养微缩的等效器官,模拟其各自的全尺寸对应器官的生物学功能和生物的主要特征,如生物流体流动,机械和电耦合,生理组织与流体、组织与组织的比率。
类器官串联芯片培养系统包括控制单元和芯片,控制单元能够模拟人体内生理环境,包括温度、压力、真空度、微流道循环频率、时间等参数,芯片有不通的微流道设计,针对不同的器官可以单独设置提供相应的培养条件,提供精JIN准的培养和分化环境。类器官串联芯片培养系统可提供不同类器官的串联共培养方案,避免单一类器官无法模拟人体复杂生理学条件下器官相互通讯交流的不足。通过类器官模拟人类器官组织的生理发育过程,应用于疾病模型、肿瘤发生、以及药物安全性、有效性、毒性、ADME等方面的评估,旨在减少和取代实验室动物测试,简化人体临床试验。
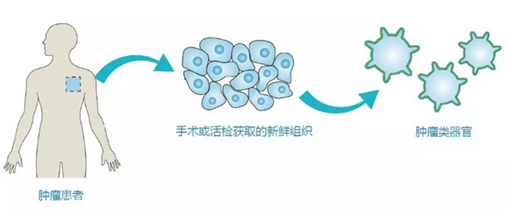
类器官是指在结构和功能上都类似来源器官或组织的模拟物,通过取特定器官的干细胞(iPS/ES),或者利用人的多能干细胞定向诱导分化,能获得微型的器官样的三维培养物,在体外模拟人体器官发育过程。
类器官,具有某一器官多种功能性细胞和组织形态结构的三维(3D)培养物,主要来源于人具有多项分化潜能的多能干细胞(包括人胚胎干细胞和人诱导多能干细胞iPSCs)或成体干细胞。人多能干细胞能分化为个体所有类型的细胞,在体外,经过诱导分化,模拟人体器官发育过程,能使人多能干细胞直接分化形成各种类器官;不同组织器官都存在内源组织干细胞,在维持各器官的功能形态发挥着重要作用。这些干细胞在体外一定的诱导条件下,可以自组织形成一个直径仅为几毫米的具有组织结构和多种功能细胞的三维培养物。器官芯片是获取两个或两个以上不同的类器官,并且放置在特定的培养芯片上进行共培养,能模拟人体的多个器官参与的生理学过程。
与传统2D细胞培养模式相比,3D培养的类器官包含多种细胞类型,能够形成具有功能的“微器官”,能更好地用于模拟器官组织的发生过程及生理病理状态,因而在基础研究以及临床诊疗方面具有广阔的应用前景。
基于这一定义,可以发现类器官具备这样几个特征:
* 必须包含一种以上与来源器官相同的细胞类型;
* 应该表现出来源器官所特有的一些功能;
* 细胞的组织方式应当与来源器官相似。
类器官作为一个新兴的技术,在科学研究领域潜力巨大,包括发育生物学、疾病病理学、细胞生物学、再生机制、精 准医疗以及药物毒性和药效试验。类器官培养使研究人体发育提供了不受伦理限制的平台,为药物筛选提供了新的平台,也是对现有2D培养方法和动物模型系统的高信息量的互补 。此外,类器官为获取更接近自然人体发育细胞用于细胞ZL成为可能。通过类器官繁殖的干细胞群取代受损或者患病的组织,类器官提供自体和同种异体细胞疗法的可行性,未来这一技术在再生医学领域也拥有巨大的潜力 。使用这项技术,采用CRISPR/Cas9能够纠正体外遗传异常并能够将健康的转基因细胞再次回输入患者体内,并在后期整合入组织内。在精 准医学应用中,患者衍生的类器官也被证明为有价值的诊断工具。在进行ZL之前,采用从患者样本来源的类器官筛查患者体外药物反应,旨在为癌症和囊胞性纤维症患者的护理提供指导并预测ZL结果。随着类器官培养系统以及其实验开发技术的不断发展,类器官应用到了各大研究领域。
类器官可以模拟人体的内外环境和人体器官,帮助研究人员观测用药会对人体器官功能产生什么样的影响。在提倡精 准医学和个体化ZL的时代,类器官研究比传统的二维细胞培养更具有针对性,并且可以区别不同癌症对于相同药物的反应。不仅如此,研究者还希望通过诱导多功能干细胞强大的再生潜能,体外生成新的器官或组织,然后移植入体内以替代损坏的组织器官。


类器官培养系统--- HUMIMIC的技术方案:在没有病人的情况下测试病人
基于这一定义,可以发现类器官具备这样几个特征:
必须包含一种以上与来源器官相同的细胞类型;
应该表现出来源器官所特有的一些功能;
细胞的组织方式应当与来源器官相似。

类器官可以模拟人体的内外环境和人体器官,帮助研究人员观测用药会对人体器官功能产生什么样的影响。在提倡精JIN准医学和个体化治ZHI疗的时代,类器官研究比传统的二维细胞培养更具有针对性,并且可以区别不同癌症对于相同药物的反应。不仅如此,研究者还希望通过诱导多功能干细胞强大的再生潜能,体外生成新的器官或组织,然后移植入体内以替代损坏的组织器官。此外,类器官为获取更接近自然人体发育细胞用于细胞治ZHI疗成为可能。通过类器官繁殖的干细胞群取代受损或者患病的组织,类器官提供自体和同种异体细胞疗法的可行性,未来这一技术在再生医学领域也拥有巨大的潜力 。在精JIN准医学应用中,患者衍生的类器官也被证明为有价值的诊断工具。在进行治ZHI疗之前,采用从患者样本来源的类器官筛查患者体外药物反应,旨在为癌症和囊胞性纤维症患者的护理提供指导并预测治ZHI疗结果。随着类器官培养系统以及其实验开发技术的不断发展,类器官应用到了各大研究领域。

类器官培养的应用案例
类器官的应用举例---疾病模型
类器官的研究还可用于于疾病模型,如发育相关问题,遗传疾病,肿瘤癌症等。
通过使用患者的iPSCs可建立有价值的疾病模型,并能在体外模拟重现病人疾病模型;同时,类器官的建立可以实现对药物药效和毒性进行更有效、更真实的检测。由于类器官可以直接由人类iPSCs直接培养生成,相比于动物模型很大程度上避免了因动物和人类细胞间的差异而导致的检测结果不一致。

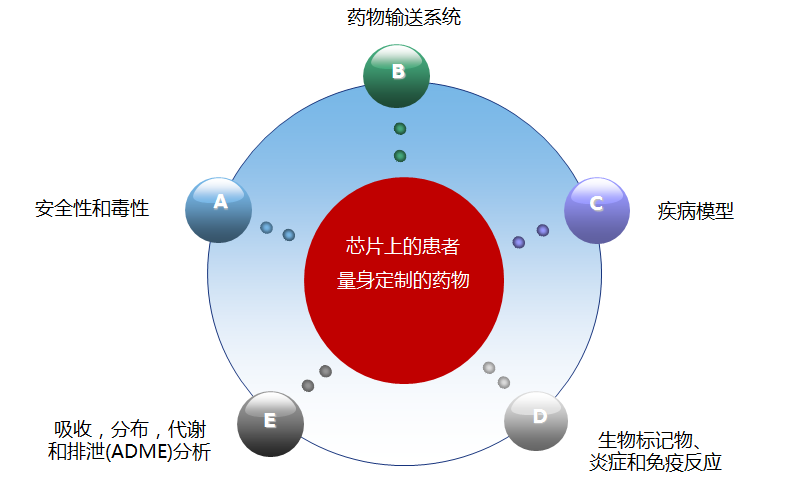
类器官的应用举例---药效和毒理测试
可以从患者来源的健康和肿瘤组织样品中建立类器官。与此同时类器官培养物可用于药物筛选,这可将肿瘤的遗传背景与药物反应相关联。来自同一患者健康组织的类器官的建立提供了通过筛选选择性杀死肿瘤细胞而又不损害健康细胞的化合物来开发毒性较小的药物的机会。自我更新的肝细胞类器官培养物可用于测试潜在新药的肝毒性(临床试验中药物失败的原因之一)。在该实施例中,药物B似乎最适合于治ZHI疗患者,因为它特异性杀死肿瘤类器官并且不引起肝毒性。

类器官的应用举例---重演肿瘤形成
类器官的培养和建立,可用于研究肿瘤生成过程中的突变过程,比如说,通过从同一肿瘤的不同区域培养无性繁殖的类细胞器,可以用来研究肿瘤内部的异质性。
来自不同健康器官的类器官的生长,然后对培养物进行全基因组测序,可以分析器官特异性突变谱。通过生长来自同一肿瘤不同区域的类器官,可以用于研究肿瘤内异质性。区域特异性突变谱可以通过类器官的全基因组测序来揭示。使用与上述相似的方法,可以利用类器官来研究特定化合物对健康细胞和肿瘤细胞突变谱的影响。

类器官的应用举例---肿瘤患者个性化医疗
有助于个性化治ZHI疗策略的设计,利用病变和正常的类器官来评估各种治ZHI疗方案。可以筛选多种活性药物和小化合物,设计更有效的用药方案。培养成熟的类器官还可以为器官再生和器官移植提供广泛的组织来源。对类器官进行基因操作来修复缺失的功能,并移植回到患者体内。

类器官的应用举例---类器官“生物Bank”
根据目前的研究进展,建立了活体类器官“生物bank”。其中,肿瘤来源的类器官在表型和基因上都与肿瘤相似。另外,肿瘤类类器官生物库使生理学相关的药物筛选成为可能。活体类器官生物库可用于确定类器官是否对个体患者的药物反应,具有预测价值。
类器官串联培养系统--- HUMIMIC的技术方案:
多器官串联培养,在没有病人的情况下测试病人
类器官串联芯片培养系统包括控制单元和芯片,控制单元能够模拟人体内生理环境,包括温度、压力、真空度、微流道循环频率、时间等参数,芯片有不通的微流道设计,针对不同的器官可以单独设置提供相应的培养条件,提供精JIN准的培养和分化环境。类器官串联芯片培养系统可提供不同类器官的串联共培养方案,避免单一类器官无法模拟人体复杂生理学条件下器官相互通讯交流的不足。通过类器官模拟人类器官组织的生理发育过程,应用于疾病模型、肿瘤发生、以及药物安全性、有效性、毒性、ADME等方面的评估,旨在减少和取代实验室动物测试,简化人体临床试验。

为获取更高相关与准确的测试结果,我们开发了人体器官模型的自动芯片测试:
配备具有指示相关性的器官模型的芯片,以能够在接触生物体之前检测其安全性和有效性;
最ZUI终为芯片配备患者自身相关病变器官的亚基,以评估整个个性化治ZHI疗的效果;
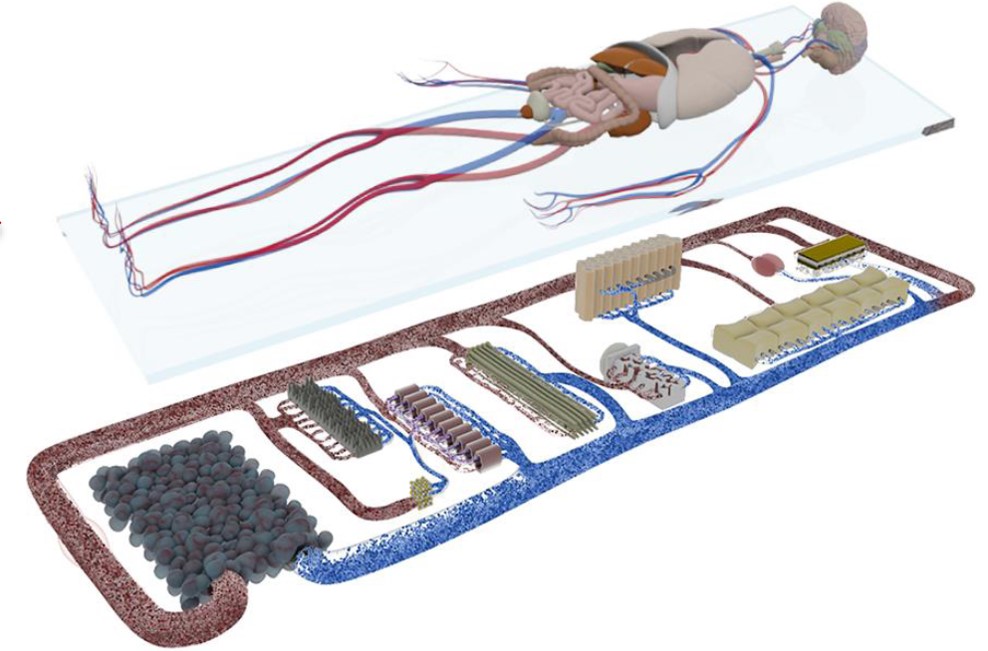
人体生理反应往往涉及更多介质循环和不同组织间相互作用,多器官芯片才能全面反映出机体器官功能的复杂性、完整性以及功能变化,一个相互作用的系统才能更好的模拟整个系统中器官和组织的不同功能。可提供不同类器官的串联培养解决方案,避免单一类器官无法模拟人体复杂生理学条件下器官相互通讯交流的不足。把多种不同器官和组织培养在芯片上,然后通过微通道连接起来,集成一个相互作用的系统,从而模拟人体中的不同功能器官的交流通讯和互相作用。
TissUse专有的商用MOC技术支持的器官培养物的数量范围从单个器官培养到支持复杂器官相互作用研究的器官数量,包括单器官、二器官、三器官和四器官培养的商业化的平台。成功的案例包括:肝脏、肠、皮肤、血管系统、神经组织、心脏组织、软骨、胰XIAN、肾脏、毛囊、肺组织、脂肪组织、肿瘤模型和骨SUI以及各自的多器官串联组合方案。
德国TissUse公司专注于类器官培养系统研究22年,推出的HUMIMIC类器官串联芯片培养系统,得到FDA的推荐,可提供不同类器官的串联培养解决方案,避免单一类器官培养无法模拟人体器官相互通讯关联的缺陷,同时也提供相关的技术方案和后续方法试剂支持,属于国际上少有的“Multi-Organ-Chip” 和“Human-on-a-chip”的方案提供者。相关方案已被广泛应用于药物开发、化妆品、食品与营养和消费产品等多个领域.
 类器官串联培养系统---HUMIMIC系统
类器官串联培养系统---HUMIMIC系统
一、专业化的硬件(控制单元)
主机(控制单元)是一个紧凑的台式设备,能够模拟人体内生理环境,包括温度、压力、真空度、微流道循环频率、时间等参数。芯片有不通的微流道设计,针对不同的器官可以单独设置提供相应的培养条件,提供精JIN准的培养和分化环境。
7寸触摸显示器,控制面板可以在整个过程中对每个多器官芯片分别进行调节,无需外接电脑,软件操控友好;
可以自主设置每个器官芯片的培养条件,包括温度、压力、真空度、微流道循环频率、时间等参数;
可串联培养2个不同(或相同)、3个不同的、4个不同的类器官;
3个连接拓展口,用于连接其他设备;
同时操控高达8个Chip3 / Chip3 plus,4个Chip2 /Chip4或这些的组合;

二、类器官芯片
芯片有不通的微流道设计,针对不同的器官可以单独设置提供相应的培养条件,提供精JIN准的培养和分化环境;
芯片的泵腔内的柔性膜通过连接的管道,受到压力或真空的作用,在微流道之中产生脉动体流;
二联类器官芯片可以在一个芯片上串联培养2个不同(或相同)的类器官;
三联类器官芯片可以在一个芯片上串联培养3个不同的类器官;
四联类器官芯片可以在一个芯片上串联培养4个不同的类器官;
三、服务方案(细胞、试剂,诱导方案)
四、器官模型和串联培养技术



类器官串联培养系统---HUMIMIC的应用案例
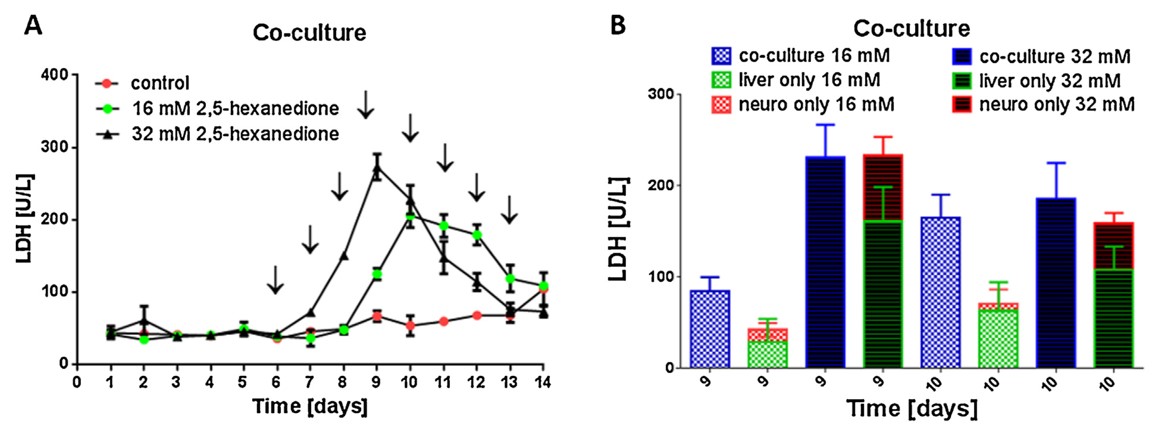
1、神经球和肝脏的串联共培养(柏林工业大学)-二联器官共培养的药物敏感性
2015, Journal of Biotechnology,
A multi-organ chip co-culture of neurospheres and liver equivalents for long-term substance testing
目前用于药物开发的体外实验平台无法模拟人体器官的复杂性,而人类和实验室动物的系统差异巨大,因此现有的方案都不能准确预测药物的安全性和有效性。德国、葡萄牙和俄罗斯的研究团队通过TissUse GmbH公司的微流控多器官芯片(MOC)平台,测试毒物对多器官的作用,揭示了基于微流控的多器官串联共培养能够更好的模拟人体的生理学环境。在体外培养条件下,由于氧气和营养供应有限,类器官培养往往会随着时间的推移而去分化。然而微流控系统中通过持续灌注培养基,更好地控制环境条件,如清除分泌物和刺激因子,并且培养基以可控流速通过,以模拟血流产生的生物剪切应力,因此类器官培养物可以保持良好的生长状态。


双器官串联芯片(2-OC)能够串联共培养人的神经球(NT2细胞系)和肝脏类器官(肝HepaRG细胞和肝HHSteC细胞)。在持续两周的实验中,反复加入神经毒剂2,5-己二酮,引起神经球和肝脏的细胞凋亡。跟单器官培养相比,串联共培养对毒剂更敏感。因此,多器官串联共培养在临床研究中可以更准确地预测药物的安全性和有效性。推测这是因为一个类器官的凋亡信号导致了第二个类器官对药物反应的增强,这一推测得到了实验结果的支持,即串联共培养的敏感性增加主要发生在较低浓度药物中。

2、心脏肝脏骨骼皮肤的串联共培养(哥伦比亚大学)-四联器官共培养的复杂通讯模型
哥伦比亚大学的科学家也开发了一种多器官串联芯片,建立了串联共培养心脏、肝脏、骨骼、皮肤的技术,发表于2022年的Nature Biomedical Engineering,中通过血液循环串联培养4个类器官,保持了各个类器官的表型,还研究了常见的抗ANTI癌药阿霉素对串联芯片中的类器官以及血管的影响。结果显示药物对串联共培养类器官的影响与临床研究结果非常相似,证明了多器官串联共培养能够成功的模拟人体中的药代动力学和药效学特征。
“最值得注意的是,多器官串联芯片能够准确的预测出阿霉素的心脏毒性和心肌病,这意味着,临床医生可以减少阿霉素的治ZHI疗剂量,甚至让患者停止该治ZHI疗方案。“
Gordana Vunjak-Novakovic, Department of Biomedical Engineering, Columbia University
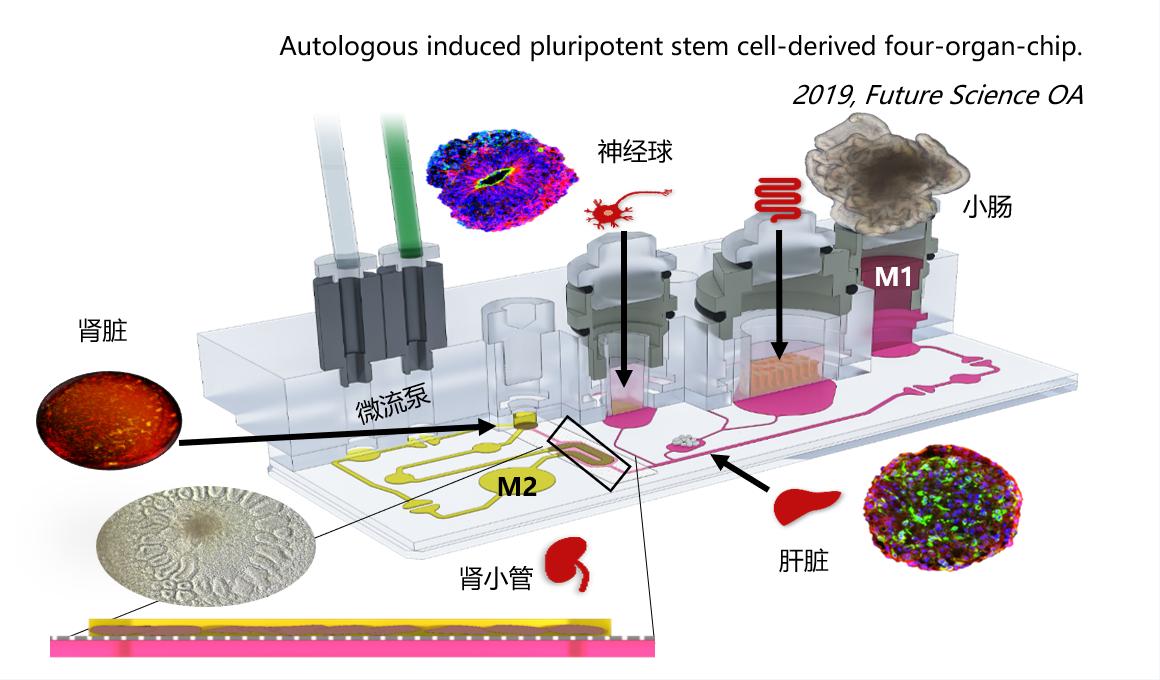

3、胰岛和肝脏在芯片上的串联共培养(阿斯利康)-二联器官共培养的反馈通讯
2017, Nature Scientific Reports,
Functional coupling of human pancreatic islets and liver spheroids on-a-chip: Towards a novel human ex vivo type 2 diabetes model
人类系统性疾病的发生过程都是通过破坏两个或多个器官的自我平衡和相互交流。研究疾病和药疗就需要复杂的多器官平台作为体外生理模型的工具,以确定新的药物靶点和治ZHI疗方法。2型糖尿病(T2DM)的发病率正在不断上升,并与多器官并发症相关联。由于胰岛素抵抗,胰岛通过增加分泌和增大胰岛体积来满足胰岛素不断增加的需求量。当胰岛无法适应机体要求时,血糖水平就会升高,并出现明显的2型糖尿病。由于胰岛素是肝脏代谢的关键调节因子,可以将生产葡萄糖的平衡转变为有利于葡萄糖的储存,因此胰岛素抵抗会导致糖稳态受损,从而导致2型糖尿病。过去已经报道了多种表征T2DM特征的动物模型,但是,从动物实验进行的研究往临床上转化的效果不佳。更重要的是,目前使用的药物,虽然能缓解糖尿病症状,但对疾病进一步发展的治ZHI疗的效果有限。
胰XIAN腺和肝脏是参与维持葡萄糖稳态的两个关键器官,为了模拟T2DM,阿斯利康(AstraZeneca)的科学家利用TissUse GmbH公司的微流控多器官芯片(MOC)平台,通过微流控通道相互连接,建立一个双器官串联芯片(2-OC)模型,实现芯片上胰XIAN腺和肝脏类器官的串联共培养,在体外模拟了胰XIAN腺和肝脏之间的交流通讯。

建立串联共培养类器官(胰岛+肝脏)和单独培养类器官(仅胰岛或肝脏),在培养基中连续培养15天,串联共培养显示出稳定、重复、循环的胰岛素水平。而胰岛单独培养的胰岛素水平不稳定,从第3天到第15天,降低了49%。胰岛与肝球体串联共培养中,胰岛可长期维持葡萄糖水平,刺激胰岛素分泌,而单独培养的胰岛,胰岛素分泌显著减少。胰岛分泌的胰岛素促进了肝球体对葡萄糖的利用,显示了串联共培养中类器官之间的功能性的交流。在单独培养中的肝球体中,15天内循环葡萄糖浓度稳定维持在~11 mM。而与胰岛共培养时,肝球体的循环葡萄糖在48小时内降低到相当于人正常餐后的水平度,表明胰岛类器官分泌的胰岛素刺激了肝球体摄取葡萄糖。

4、肺肿瘤和皮肤在芯片上的串联共培养(拜耳)-抗体药物对肿瘤和正常器官的影响
针对EGFR抗体的药物在癌症治ZHI疗中被广泛应用。然而,抗ANTI癌药物的使用量与皮肤不良反应成正比相关,皮肤毒性是上皮生长因子受体(EGFR) 靶向治ZHI疗中最常见的副作用。但是对于后者的预测目前的方法均无法实现。
双器官串联芯片(2-OC)模型,实现芯片上皮肤和肿瘤的共培养,用于模拟重复给药的剂量实验,同时还生成安全性和有效性的数据,可以在非常早的阶段检测到西妥昔单抗cetuximab对皮肤的几个关键副作用。这种体外分析能够在临床表现之前预评估毒性副作用,可以替代动物试验,有望成为评价EGFR抗体和其他肿瘤药物治ZHI疗指数的理想工具。

5、皮肤-肝脏在芯片上的串联共培养(拜尔斯道夫公司)—评估化妆品不同的给药途径
一种独特的基于芯片的组织培养平台已经开发出来,使化妆品和药物对一套微型人体器官的影响测试成为可能。这种“人-片”平台旨在生成可复制的、高质量的人体物质安全性预测体外数据。被测物质进入表皮或在表皮内代谢,然后泵入肝脏并激活相应的CYPs。因此,在肝脏和皮肤的联合培养中,多器官芯片是一种有前途的体外方法,用于全身和局部剂量的化妆品和药物。
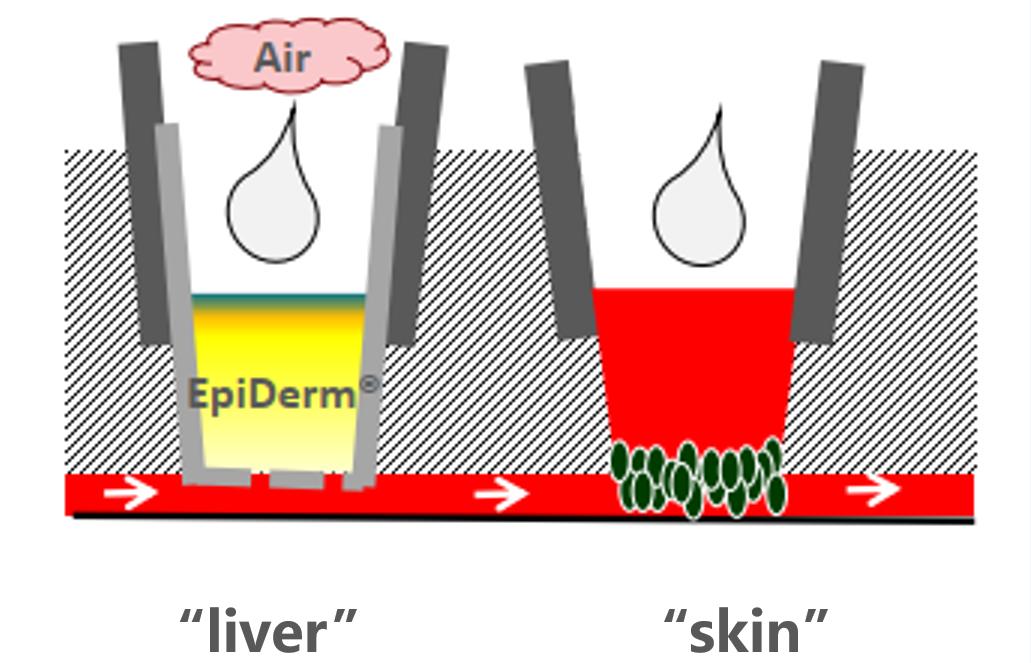

皮肤等效物的培养整合在一个系统中。芯片上的微泵使代谢运输和附加的生理剪切应力成为可能。肝脏和皮肤等效物存活10天,并显示紧密连接和特异性转运蛋白的表达。每天服用、维甲酸和倍他米松-21-戊酸,持续7天,以研究已知可被皮肤和肝脏代谢的化合物的作用。将表面敷于表皮的效果与直接敷于培养基的效果进行比较,分析对皮肤渗透和代谢的影响。对肝脏和皮肤等价物进行代谢酶、转运体、分化标记物的表达和活性分析。结果显示,在蛋白水平和mRNA水平上,根据不同物质处理,ⅰ、ⅱ期酶均有本构性和诱导性表达。因此,在肝脏和皮肤的联合培养中,多器官芯片是一种有前途的体外方法,用于全身和局部剂量的药物和化妆品。

6、肺类器官在芯片上的培养(菲莫国际)-空气环境对呼吸道的影响
使用类人肺模型研究吸入气溶胶的沉积和吸附,从而使体外人体呼吸毒性的数据更加准确和可预测。目前的体外气溶胶暴露系统通常不能模拟这些特性,这可能导致在体外生物测试系统中交付非现实的、非人体相关的可吸入试验物质剂量。模拟和研究体外气溶胶暴露装置-吸入器可主动呼吸、操作医用吸入器,或吸吸烟草制品。此外,它可以填充从人类呼吸道不同区域分离的三维上皮细胞。包括口腔、支气管和肺泡细胞培养物的气溶胶传递和相容性的概念的研究,将其应用于测试系统,吸入产生的生理条件下,测试表现在人的呼吸道的方式。这种方法的优点是,它无需花费昂贵、耗时和具有科学挑战性的工作来确定体内提供的剂量,默认情况下,适用于任何测试烟草燃烧产生的气体和任何测试成分。
类器官串联培养系统---HUMIMIC的参考文献
2023, Journal of Applied Toxicology, Early View, Application of a skin and liver Chip2 microphysiological model to investigate the route-dependent toxicokinetics and toxicodynamics of consumer-relevant doses of genistein
Tao TP, Brandmair K, Gerlach S, Przibilla J, Schepky A, Marx U, Hewitt NJ, Maschmeyer I, Kühnl J
2023, Journal of Applied Toxicology, Early View, Suitability of different reconstructed human skin models in the skin and liver Chip2 microphysiological model to investigate the kinetics and first-pass skin metabolism of the hair dye, 4-amino-2-hydroxytoluene
Brandmair K, Tao TP, Gerlach S, Przibilla J, Schepky A, Marx U, Hewitt NJ, Kühnl J, Maschmeyer I
2023, Scientific reports, Vol. 13, Microfluidic-based prostate cancer model for investigating the secretion of prostate-specific antigen and microRNAs in vitro
Padmyastuti A, Sarmiento MG, Dib M, Ehrhardt J, Schoon J, Somova M, Burchardt M, Roennau, Pinto PC
2023, bioRxiv, Preprint, Diseased human pancreas and liver microphysiological system for preclinical diabetes research
Rigal S, Casas B, Kanebratt KP, Wennberg Huldt C, Magnusson LU, Mullers E, Karlsson F, Clausen M, Hansson SF, Jansson Lofmark R, Ammala C, Marx U, Gennemark P, Cedersund G, Andersson TB, Vilen LK
2023, Alternatives to Laboratory Animals, OnlineFirst, Advances in Animal Models and Cutting-Edge Research in Alternatives: Proceedings of the Third International Conference on 3Rs Research and Progress, Vishakhapatnam, 2022
Naik NN, Vadloori B, Poosala S, Srivastava P, Coecke S, Smith A, Akhtar A, Roper C, Radhakrishnan S, Bhyravbhatla B, Damle M, Pulla VK, Hackethal J, Horland R, Li AP, Pati F, Singh MS, Occhetta P, Bisht R, Dandekar P, Bhagavatula K, Pajkrt D, Johnson M, Weber T, Huang J, Hysenaj L, Mallar B, Ramray B, Dixit S, Joshi S, Kulkarni M
2023, Frontiers in Pharmacology, Vol. 14, Development of a microphysiological skin-liver-thyroid Chip3 model and its application to evaluate the effects on thyroid hormones of topically applied cosmetic ingredients under consumer-relevant conditions
Tao TP, Maschmeyer I, LeCluyse EL, Rogers E, Brandmair K, Gerlach S, Przibilla J, Kern F, Genies C, Jacques C, Najjar A, Schepky A, Marx U, Kühnl J, Hewitt NJ
2022, Biomaterials and Biosystems , Vol. 7, Setup of human liver-chips integrating 3D models, microwells and a standardized microfluidic platform as proof-of-concept study to support drug evaluation
Cox B, Barton P, Class R, Coxhead H, Delatour C, Gillent E, Henshall J, Isin EM, King L, Valentin JP
2022, Journal of Extracellular Vesicles, Vol. 11, A human kidney and liver organoid-based multi-organ-on-a-chip model to study the therapeutic effects and biodistribution of mesenchymal stromal cell-derived extracellular vesicles
Nguyen VVT, Ye S, Gkouzioti V, van Wolferen ME, Yengej FY, Melkert D, Siti S, de Jong B, Besseling PJ, Spee B, van der Laan LJW, Horland R, Verhaar MC, van Balkom BWM
2022, Cells, Vol. 11, A Human Stem Cell-Derived Brain-Liver Chip for Assessing Blood-Brain-Barrier Permeation of Pharmaceutical Drugs
Koenig L, Ramme AP, Faust D, Mayer M, Flötke T, Gerhartl A, Brachner A, Neuhaus W, Appelt-Menzel A, Metzger M, Marx U, Dehne EM
2022, Pharmaceutics, Vol. 14, Proof-of-Concept Organ-on-Chip Study: Topical Cinnamaldehyde Exposure of Reconstructed Human Skin with Integrated Neopapillae Cultured under Dynamic Flow
Vahav I, Thon M, van den Broek LJ, Spiekstra SW, Ataҫ B, Lindner G, Schimek K, Marx U, Gibbs S
2022, ALTEX, A microfluidic thyroid-liver platform to assess chemical safety in humans
Kühnlenz J, Karwelat D, Steger-Hartmann T, Raschke M, Bauer S, Vural Ö, Marx U, Tinwell H, Bars R
2022, Frontiers in Toxicology, A Multi-Organ-on-Chip Approach to Investigate How Oral Exposure to Metals Can Cause Systemic Toxicity Leading to Langerhans Cell Activation in Skin
Koning JJ, Rodrigues Neves CT, Schimek K, Thon M, Spiekstra SW, Waaijman T, de Gruijl TD, Gibbs S
2021, Drug Testing and Analysis, Early view, Organ-on-a-chip: Determine feasibility of a human liver microphysiological model to assess long-term steroid metabolites in sports drug testing
Görgens C, Ramme AP, Guddat S, Schrader Y, Winter A, Dehne EM, Horland R, Thevis M
2021, Science, Vol. 373, Human microphysiological systems for drug development
Roth A, MPS-WS Berlin 2019
2021, Frontiers in Medicine, Vol. 8, An Individual Patient's "Body" on Chips – How Organismoid Theory Can Translate Into Your Personal Precision Therapy Approach
Marx U, Accastelli E, David R, Erfurth H, Koenig L, Lauster R, Ramme AP, Reinke P, Volk HD, Winter A, Dehne EM
2021, Stem Cell Research, Vol. 53, Generation of two additional integration-free iPSC lines from related human donors
Ramme AP, Faust D, Koenig L, Nguyen N, Marx U
Cell line repository/bank: Human Pluripotent Stem Cell Registry (hPSCreg)
2021, Journal of Applied Toxicology, Early view, Demonstration of the first‐pass metabolism in the skin of the hair dye, 4‐amino‐2‐hydroxytoluene, using the Chip2 skin–liver microphysiological model
Tao TP, Brandmair K, Gerlach S, Przibilla J, Géniès C, Jacques‐Jamin C, Schepky A, Marx U, J. Hewitt N, Maschmeyer I, Kühnl J
2021, Toxicology, Vol. 448, Characterization of application scenario-dependent pharmacokinetics and pharmacodynamic properties of permethrin and hyperforin in a dynamic skin and liver multi-organ-chip model
Kühnl J, Tao TP, Brandmair K, Gerlach S, Rings T, Müller-Vieira U, Przibilla J, Genies C, Jaques-Jamin C, Schepky A, Marx U, J. Hewitt N, Maschmeyer I
2020, TissUse White Paper, Multi-Organ Microphysiological Systems are Poised for Expansive Integration
2020, Scientific reports. Vol. 10, Repeated dose multi-drug testing using a microfluidic chip-based coculture of human liver and kidney proximal tubules equivalents
Lin N, Zhou X, Geng X, Drewell C, Hübner J, Li Z, Zhang Y, Xue M, Marx U, Li B
2020, In Vitro Cellular & Developmental Biology – Animal, The microfollicle: a model of the human hair follicle for in vitro studies
Ataç B, Kiss FM, Lam T, Fauler B, Edler C, Hu P, Tao TP, Jädicke M, Rütschle I, Azar RP, Youngquist S, Mielke T, Marx U, Lauster R, Lindner G, DiColandrea T
2020, International Journal of Pharmaceutics, Vol. 589, Toxicity of topically applied drugs beyond skin irritation: Static skin model vs. Two organs-on-a-chip
Tavares RSN, Tao TP, Maschmeyer I, Maria-Engler SS, Schäfer-Korting M, Winter A, Zoschke C, Lauster R, Marx U, Gaspar LR
2020, Advanced Science, Metal‐Specific Biomaterial Accumulation in Human Peri‐Implant Bone and Bone Marrow
Schoon J, Hesse B, Rakow A, Ort MJ, Lagrange A, Jacobi D, Winter A, Huesker K, Reinke S, Cotte M,Tucoulou R, Marx U, Perka C, Duda GN, Geissler S
2020, Human Reproduction, Vol. 35, A multi-organ-chip co-culture of liver and testis equivalents: a first step toward a systemic male reprotoxicity model
Baert Y, Ruetschle I, Cools W, Oehme A, Lorenz A, Marx U, Goossens E, Maschmeyer I
2020, Scientific Reports, Human multi-organ chip co-culture of bronchial lung culture and liver spheroids for substance exposure studies
Schimek K, Frentzel S, Luettich K, Bovard D, Rütschle I, Boden L, Rambo F, Erfurth H, Dehne EM, Winter A, Marx U, Hoeng J
2020, Journal of Tissue Engineering and Regenerative Medicine, Vol. 14, Reconstructed human skin shows epidermal invagination towards integrated neopapillae indicating early hair follicle formation in vitro
Vahav I, van den Broek LJ, Thon M, Monsuur HN, Spiekstra SW, Atac B, Scheper RJ, Lauster R, Lindner G, Marx U,
北京佰司特科技有限责任公司
仪器网(yiqi.com)--仪器行业网络宣传传媒