双荧光素酶报告基因检测(三)
萤火虫荧光素酶片段互补成像(LCI)技术是一种新兴的蛋白质相互作用研究方法,其中两个被研究的目标蛋白质分别与萤火虫荧光素酶的N端和C端相连。当这两个蛋白质发生相互作用时,荧光素酶的两个段落会接近并组合成一个活性酶。结合烟草瞬时表达系统的LCI技术,能够在植物细胞内进行实时和定量的蛋 白质互作分析。这种方法不受植物自身荧光的干扰,操作简便,无需细胞裂解或蛋白提取,有效地反映了植物在生理条件下蛋白质的相互作用状态。
与其它蛋白质互作研究技术相比, 借助于烟草(Nicotiana benthamiana)瞬时表达系统的萤火素酶互补实验(LCA)具有简单、灵敏、可靠、高效和低背景等优点, 并可轻松扩展为大规模蛋白质互作的筛选和验证研究。萤火素酶互补实验定性并定量分析生物发光或发光强度, 从而检测植物目标蛋白之间的相互作用。
荧光素酶互补法(LCI)
荧光素酶互补实验(LCA)是将荧光素酶分为N端(NLuc)和C端(CLuc)两个功能性片段。在此实验中,两个待研究的目标蛋白分别与NLuc和CLuc融合。当这两个目标蛋白发生相互作用时,它们将NLuc和CLuc拉近,使得荧光素酶的活性得以恢复,进而催化荧光素底物发光。由于其高灵敏度、定量化能力和简便的操作流程。LCA技术已在植物和动物学的蛋白质互作研究中得到广泛应用。
在此技术的应用中,萤火虫荧光素酶的N端和C端片段只有在被分别融合到相互作用的蛋白质上时才能恢复其活性,这一过程可以通过植物活体成像系统进行观测。LCA技术适用于蛋白质相互作用的瞬时表达或稳定的转基因表达研究。
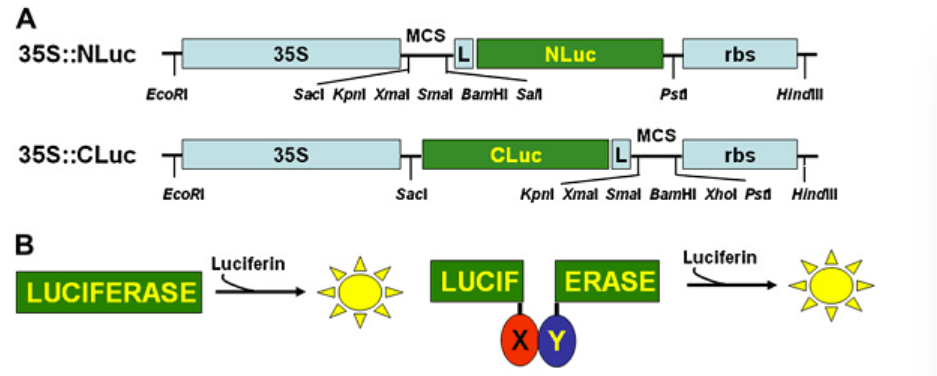
图1 利用荧光素酶互补实验验证植物蛋白互作原理
实验方法
① 分别将待测蛋白质的基因克隆到含有CLuc和NLuc编码序列的质粒中,然后将所得质粒转入农杆菌中。
② 将含有这两种质粒的农杆菌细菌浸入本氏烟草中,以便重组DNA可以被传递到植物细胞中并稳定表达。
③ 收集表达测试蛋白质的叶组织,通过植物活体成像系统和高灵敏度发光检测仪检测生物发光的强度,从而对蛋白之间的相互作用进行定性和定量分析。
Z初开发用于检测哺乳动物活细胞中的蛋白质-蛋白质相互作用,但后来被用于植物的研究中。借助于烟草的瞬时表达系统,将含有融合蛋白的表达载体转化农杆菌后注射烟草叶片,培养2-3天后,在注射部位均匀涂抹反应底物(荧火素)。通过植物活体成像系统 (CCD imaging system)或高灵敏度发光检测仪(luminometer)检测生物发光的强度,从而对蛋白之间的相互作用进行定性和定量分析。此方法已被广泛应用于动植物相关领域的蛋白质互作研究。
优/缺点
优点:
① 高度定量,允许在几个数量级的范围内对发光信号进行线性测量。
② 与FRET和BiFC相比,此法可对整个组织或细胞群进行采样,避免了来自单个细胞的偏差。
③ 在黑暗中测量发光,不受叶绿素和细胞壁产生的自荧光的影响。
④ 可用于在组织水平上研究蛋白质-蛋白质相互作用,该技术对于研究组织特异性蛋白质-蛋白质相互作用非常有用。
⑤ 无需显微镜,通过使用植物活体成像系统和板式发光检测仪可以在1-2分钟内收集数据,进行定性和定量分析,同时检测大量的蛋白质组。
⑥ 需要Z少的样品处理和实验室培训,操作简便,实验高效。
⑦ LCI作为植物蛋白质相互作用研究的简单工具的可用性将有助于验证从酵母双杂交分析中收集的蛋白质相互作用组数据。
缺点:
萤火虫萤光素酶(Fluc)是SLC技术中Z常用的萤光素酶,但Fluc的N端和C端片段体积过大,在某些情况下可能会干扰融合蛋白的功能或互作。
卡梅德生物(KMD Bioscience)(https://www.kmdbioscience.cn/) 建立了完善的细胞培养平台,能够提供给客户多种细胞学基础实验,可以提供优质的免疫检测服务—双荧光素酶标记基因检测。
我们通过以下两个案例来进行分析:
案例
(一)蛋白质OsXLG2-OsBIK1互作实例:参考文献:Luciferase Complementation Assay for Detecting Protein Interactions, DOI:10.1038/s41477-021-00951-9
待检测的2个目标蛋白OsXLG2和OsBIK1分别与NLuc和CLuc融合, 如果2个目标蛋白相互作用, 则萤火素酶的NLuc和CLuc在空间上会足够靠近并正确组装, 从而发挥萤火素酶活性, 即分解底物产生荧光。本实验借助烟草(Nicotiana benthamiana)瞬时表达系统, 将含有融合蛋白的植物表达载体转化农杆菌(Agrobacterium tumefaciens)后注射烟草叶片。24–48小时后, 加入反应底物萤火素, 利用植物活体分子影像系统(CCD imaging system)或luminometer来定性定量检测荧光强度, 以判定目标蛋白之间OsXLG2和OsBIK1是否存在相互作用及互作的程度。
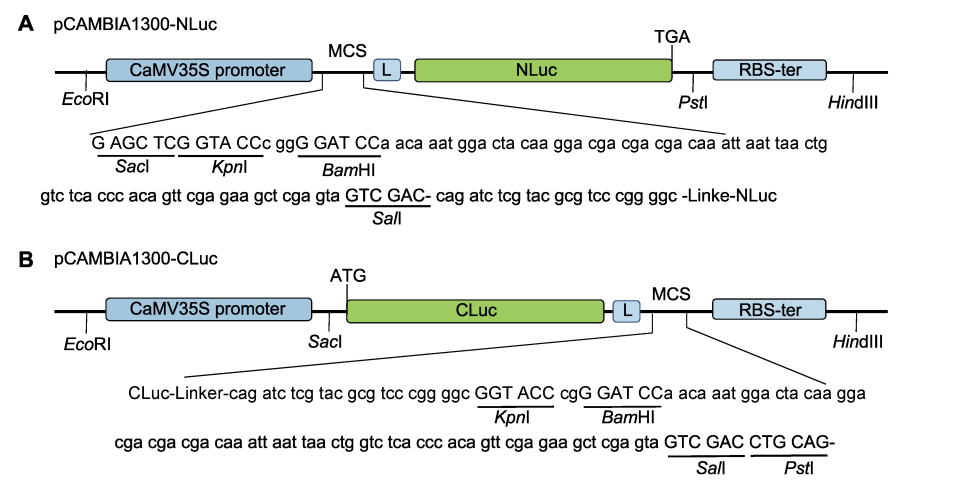
Fig.1 pCAMBIA1300-NLuc (pNL); (B) pCAMBIA1300-CLuc (pCL)。构建的表达载体中均包含pCAMBIA1300骨架, NLuc位于目标基因C末端, CLuc位于目标基因的N末端或C末端; 序列中显示的是单酶切位点。利用pNL和pCL中的酶切位点将目标基因与报告基因融合, 获得含有目标基因的重组质粒。
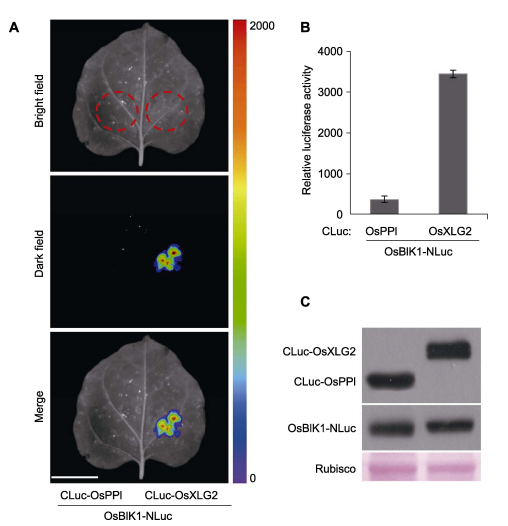
Fig.2 将分别含有CLuc-OsXLG2和OsBIK1-NLuc质粒的农杆菌液1:1体积比混合后注射4周龄烟草叶片, 24–48小时后进行检测, 以CLuc-OsPPI和OsBIK1-NLuc作为负对照(未发表)。(A) 利用植物活体成像系统采集烟草叶片的发光图像(Bar=2 cm); (B) 使用luminometer检测萤火素酶活性, 误差表示平均值的标准偏差(n=8); (C) Western blot检测CLuc和NLuc融合蛋白的表达, 融合蛋白分别用anti-luciferase和anti-CLuc抗体来检测。
(二)参考文献:Photoexcited phytochrome B interacts with BZR1 to repress brassinosteroid signaling in Arabidopsis, DOI:10.1111/jipb.12822
该研究发现红光受体phyB可以直接与BZR1转录因子物理互作并下调BR信号转导,从而减慢下胚轴伸长生长。植物光受体光敏色素B (phyB)介导植物的多种光反应。在这项研究中,为了进一步阐明phyB调控下胚轴伸长的分子机制,作者进行了荧光素酶互补实验(LCI)筛选与phyB相互作用的转录因子(TFs)。LCI分析表明,phyB与BZR1、BZR2、ARF6和WRKY36/54/70等转录因子呈现红光依赖的物理互作。进一步生化分析表明,红光激活的phyB特异性的与非磷酸化的BZR1相互作用,而非磷酸化的BZR1在BR信号转导过程中是具有生理活性的,这种相互作用可以被光信号途径负调控因子PIF4竞争性地干扰。此外,该研究还发现phyB可以直接与BZR1的DNA结合域相互作用,从而影响BZR1在靶基因染色质上的富集。遗传证据和RNA-seq分析表明,phyB负调控BR信号途径。总之,该研究揭示了光激活的phyB通过直接与BR信号途径核心转录因子BZR1相互作用,从而负调控BR介导下胚轴伸长生长。
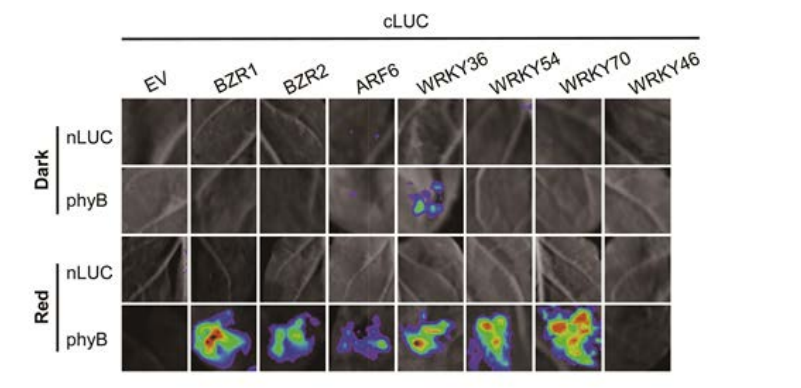
Fig 1.Identification of phyB-interacting transcription factors LCI assays showing the interactions between phyB and transcription factors in N.benthamiana leaves under dark and red light conditions. Representative images of N. benthamiana leaves after infiltration were shown. Empty vectors were used as negative controls.
这篇文章可供科研爱好者参考。它不能代替需要更详细和专业信息的专业知识或实践实验程序。如果有任何内容侵权,请联系作者立即删除有争议的材料。
全部评论(0条)
推荐阅读
-
- 上新 | 双荧光素酶报告基因检测服务震撼上线,开启精准基因研究新视界
- 上新 | 双荧光素酶报告基因检测服务震撼上线,开启精准基因研究新视界
-
- 新品上市 | Bio-Firefly荧光素酶报告基因检测系统-超高灵敏度和发光强度
- YEASEN推出Bio-Firefly萤火虫萤光素酶报告基因检测试剂盒,具有高灵敏度和发光信号稳定的特点。
-

- 5分钟快速检测!一步法荧光素酶报告基因检测试剂让检测更加简单高效!
- 5分钟快速检测!一步法荧光素酶报告基因检测试剂让检测更加简单高效!
-

- 精品推荐 | 翌圣荧光素酶报告基因检测试剂, 信号半衰期高达5h,高通量药物筛选无忧
- 翌圣荧光素酶报告基因检测系列产品提供简便、高效的定量检测方案。单一组分设计简化了使用流程,高灵敏度与5小时超长信号半衰期的完美结合,满足大规模药物筛选检测需求。
-
- 【开学特惠】荧光素酶试剂盒上新,助力新学期!
- 绿意萌动,与您共享美好时光!
-

- 阿拉丁荧光链霉亲和素:解锁细胞秘密的光之钥匙!
- 阿拉丁荧光链霉亲和素:解锁细胞秘密的光之钥匙!
-

-
- 【用户会速递】大会报告(三)实验室定量分析结果测量不确定度评估
- 第十六届马尔文帕纳科X射线分析仪器用户技术交流会将于9月18-20日在上海举行
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
最新话题
最新资讯
- 艾康全心 实验室分析检测公司 化学试剂检测 价格低
- 政策红利已至!助力全国食品安全检测机构能力升级!
- 展会预告|中国力学学会-第八届青年学术会议威科工业与您相约!
- 上海新诺仪器参加第二十二届中国国际科学仪器及实验室装备展览会
- 告客户书(一):关于美国线产品价格及货期调整
- 诚邀莅临 | 德国元素参加第二十八届青岛市分析测试学会年会
- 4月14日!倒计时开启!亚洲首家新能源电池力学实验室揭幕仪式暨新能源电池力学测试论坛将启动!
- MC镁瑞臣论文奖励丨西安工程大学:刘甜、朱炜凭借使用我们MC镁瑞臣的产品,发表了最新光解水的研究成果!
- MC镁瑞臣论文奖励丨淮北师范大学:胡成凭借使用我们MC镁瑞臣的产品,发表了最新光催化二氧化碳还原的研究成果!
- 展会邀请丨MC镁瑞臣受邀参展2025第八届华人光催化材料学术研讨会4月11-14日我们在现场邀您莅临!
作者榜


















参与评论
登录后参与评论