肝素结合蛋白(HBP)介绍
2023-08-29351炎症标志物包括肝素结合蛋白(HBP)、白细胞介素6(IL-6)、血清淀粉样蛋白A(SAA)、血清 C 反应蛋白(CRP)以及血清降钙素原(PCT)等。肝素结合蛋白 (Heparin-binding protein,HBP)由成熟中性粒细胞分泌,属于颗粒蛋白。大部分的HBP存在于嗜天青颗粒中,少量存在于分泌小泡中。与其他生物标志物相比,HBP具有灵敏度高、特异性强及感染初期就可检测出的优势,目前已知成熟的HBP相对分子量为24000,其结构包含222个氨基酸。HPB是丝氨酸蛋白酶家族成员,无蛋白酶活性,对脂多糖脂质A具有高亲和力。是一种具有杀菌功能和趋化特性的多功能单链糖蛋白。
卡梅德生物(KMD Bioscience)利用自身对抗体及蛋白质的结构-功能的经验知识储备、结合成熟的生物信息学预测能力成功开发出HBP抗原抗体诊断原料。目前,卡梅德生物的抗体平台包括:单克隆抗体制备服务平台、多克隆抗体制备服务平台、噬菌体抗体文库技术平台、抗体测序与应用平台等四大平台。卡梅德生物能够为客户提供的所有抗体均进行严格的检测以确保其纯度和灵敏度适用于多种不同诊断平台,例如LFIA、ELISA,CLIA,POCT等。
HBP结构特点:
肝素结合蛋白 (HBP)作为胰蛋白酶样丝氨酸蛋白酶家族的一员,但HBP没有蛋白酶的活性,原因是位于第 41位的组氨酸残基和第175位的丝氨酸残基分别被丝氨酸残基和甘氨酸残基所替代。尽管如此,HBP仍具备胰蛋白酶样丝氨酸蛋白酶家族催化中心的特征结构-β桶形结构。其为6条反向平行的β链组成,因此HBP与BPTI结合的能力没有丢失。
HBP存在结合内毒素的能力。HBP蛋白序列中第20-44位氨基酸残基组成v型结构,位于此v型区域内,相对裸露区域的25位苯丙氨酸残基、26位胱氨酸残基、42位胱氨酸残基和位于v型顶点的43位苯丙氨酸残基组成一个不亲水的口袋结构,由此HBP对内毒素脂质A成分具有亲和力。使得其具备结合内毒素的能力。
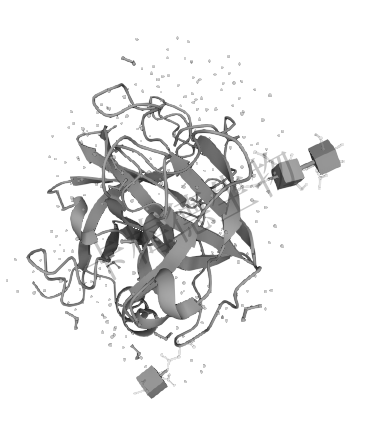
图一 HBP的分子结构示意图
(https://www.uniprot.org/uniprotkb/P20160/)
HBP的生物学功能
肝素结合蛋白(HBP)由多形核白细胞分泌。具有优异的杀菌性能、趋化特性和调节炎症的能力。作为一种重要的颗粒蛋白。大量正电荷的氨基酸残基存在于HBP结构上,而EC表面被多糖包被(带有大量的负电荷),因此多糖包被成为了EC表面结合HBP的结合位点。两者结合刺激机体内小G蛋白家族的Rho通路。使得EC通透性增加,大量HBP释放,引起单核/巨噬细胞的趋化和激活,增强其吞噬作用,释放高毒性的氧自由基,起到杀菌效果。此时,肿瘤坏死因子-α(TNF-α)和ƴ-干扰素(IFN-ƴ)等细胞因子释放增加,加重炎症反应。膜蛋白CD64、CD32表达水平增加,增加IgG的结合位点,产生免疫效果。
产品及优势:
卡梅德生物自主研发生产肝素结合蛋白产品,通过用HBP抗原免疫小鼠获得鼠抗人HBP单克隆抗体(检测)和(捕捉),特异性强,批次间差异小,支持科研人员进行HBP蛋白靶点的活性研究和蛋白相互作用的研究。并且可应用于侧流免疫层析测定(LFIA)、化学发光免疫分析(CLIA)以及酶联免疫吸附测定(ELISA)等。卡梅德提供多样化的蛋白产品,包括重组蛋白、病毒蛋白及细菌蛋白等,所提供的蛋白产品全部经过严格的QC验证,具有低内毒素含量,高纯度等特点。平台拥有经验丰富的研发团队和成熟的质量管理体系,可根据客户的研发需求,从基因序列设计,蛋白表达宿主选择,到单克隆抗体制备的每一个研发环节提供定制化服务,满足诊断原料开发,科研等不同应用需求
-
- Rabbit HCP Polyclonal Antibody
- 品牌:卡梅德
- 型号:


