通过光学成像测量清醒的小鼠脑血流和血流动力学改变
2022-06-06254今天我们向大家介绍一种测量清醒状态下的小鼠脑血流检测方法,文章中作者通过光学相干断层成像(OCTA)和内在光学信号成像(IOSI)检测完全清醒小鼠的脑血流和血流动力学。文章中详细介绍了颅骨窗的准备过程,并对清醒的小鼠脑部血流进行稳定的光学记录,以及实现多参数血流动力学测量的成像方法。结果表明,通过使用OCTA技术,可以在动物完全清醒状态下可靠地绘制出高分辨率的脑血管系统,包括穿透性小动脉和毛细血管床的流速测量。Z后,文章展示了在小鼠清醒状态下施加触须刺激时小鼠脑部皮质层的血流动力学改变。相信这里介绍的这种方法将有助于记录在清醒正常状态下的动物模型的真实血流动力学改变,这为许多新的研究方向打开了全新的视野,并可以将将神经刺激与微循环的改变进行更紧密的联系和研究。
颅窗的建立和检测设备的搭建
首先作者在第0天通过异氟醚全麻对小鼠进行颅骨窗手术,然后在动物房进行手术恢复7天。在恢复期内,除了基本的术后监护和颅窗数码摄影外,没有进行任何影像学和训练。从第8天开始,每天将小鼠带回实验室,进行至少连续4天的处理和训练,以使其适应实验室环境、实验者和头部约束装置,老鼠在头部约束成像之前接受了额外的训练(详细见原文链接)。在研究的第12天开始进行第一次清醒成像,使用IOSI和OCTA进行头部约束成像所需的Z长时间为40分钟。为了进行演示,我们在老鼠身上执行了IOSI和所有三种OCTA协议,但是可以根据未来研究的目的选择性地执行这些协议。如果操作和训练良好,老鼠可以每天成像,长达4个月。在实验的Z后一天,老鼠被麻醉成像然后anlesi,或者在麻醉下直接anlesi。
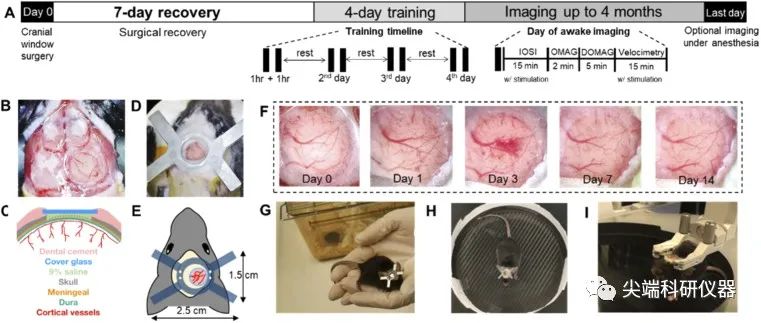
图一:A) 实验时间线。B) 安装颅骨窗的脑部显微镜图像。C) 开颅手术的横断面解剖。D) 安装固定装置和颅窗后的显微镜图像。E) 颅骨植入物的示意图和尺寸。F) 从第0天到第14天颅骨窗的一系列显微镜图像。G) ,H)和I)头部约束装置的3步操作/培训。
在使用OCTA采集脑部血流信号的过程中,使用内部构建的双模光学成像平台。OCTA在小鼠脑组织中达到∼5.1µm的轴向分辨率和∼10µm的横向分辨率。并为样品提供2.22 mm的成像深度。下图为实验过程中示意图。
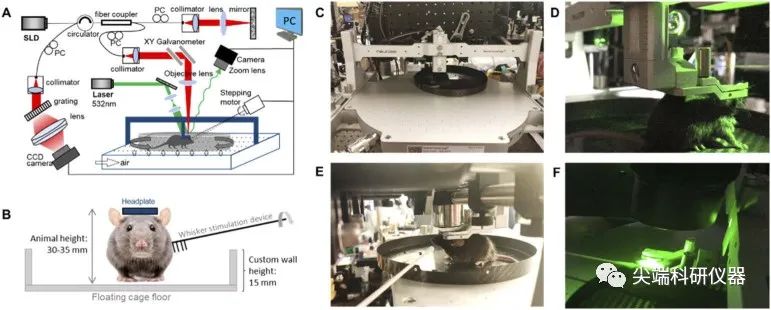
图二:A)光学成像系统的示意图。SLD:超发光二极管,PC:偏振控制器,PC(bold):个人计算机。B)鼠标触须刺激设置的示意图。C)和E)使用OCTA成像。D)和F)使用IOSI进行成像。
OCTA技术在清醒小鼠脑血流显像中的应用
在建立颅窗模型后第14天,作者使用OCTA扫描成像在清醒小鼠中获得了高分辨率的血管系统图像和血流灌注动力学图像。下图中的所有结果都是在清醒的小鼠处于静息状态(无刺激)时获得的。结果显示了小鼠脑部的三维血管系统的血管图像并获得了此范围内的断层图像,通过这些图像作者发现在皮质层上方生长着一层血管丰富的脑膜组织,这在之前的急性颅骨窗中没有发现。因此为了增强皮质血管系统的可视化,作者使用半自动分割软件将颅窗下的脑组织分离成脑膜层(L1)和皮质层(L2),如图3(C)中的黄色分割线所示。在去除L1中的尾随伪影后,生成新的正面投影图像图3(L2)。与图3(A)中的原始投影图像相比,L2的皮质血管系统可以得到更好的成像效果和对比度。之后作者又通过DOCTA对颅窗进行成像并进行血流检测,结果显示穿透小动脉(绿色)和上升小静脉(红色)的双向轴向速度,速度范围为6.1 mm/s至-6.1 mm/s如图3(D)。为了更准确地评估毛细管动力学,作者将直径大于15µm的较大血管进行掩蔽来去除信号。进一步处理的速度图如图3(F)所示。图3(G)和图3(H)中的横截面展示了掩蔽大流量信号前后的差异。
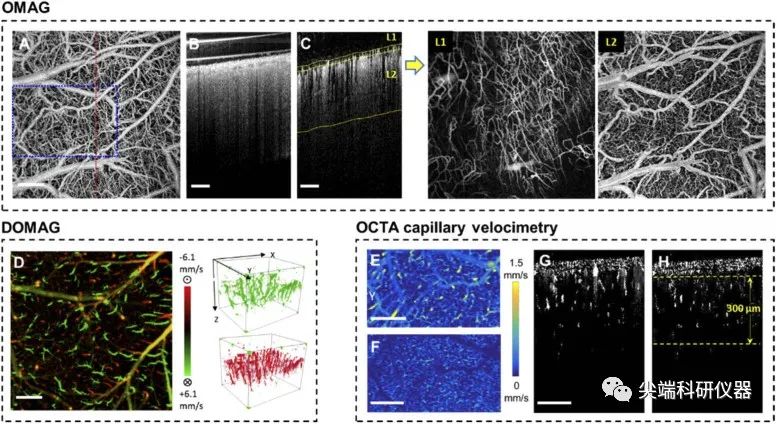
图三:A) 颅窗手术后第14天清醒小鼠静息状态下全深度3D-OCTA数据集的EN-FACE面Z大强度投影(MIP)。B) OCTA断层结构在图A中红色虚线位置的横截面。C)带有L1和L2黄色分割线的OCTA血流横截面。右侧显示了两个分割层的EN-FACE面图像。D) 利用三维DOCTA数据集的MIP生成双向轴向速度图。彩色条代表红细胞在±6.1 mm/s范围内从皮质表面下降(正,绿色)和上升(负,红色)的血流轴向速度。E) 和F)显示了300µm厚平面内3D毛细管速度测量数据集的平均强度投影(AIP),分别对应于它们的横截面G)和H)。此图中的所有比例尺代表500µm。
清醒小鼠触须刺激的血流动力学研究
接着作者使用IOSI揭示了清醒状态下小鼠桶状皮质神经活动引起的血流动力学变化。图4(A)上图显示了尚未触须刺激时,图像采集时的相对反射率(-ΔR/R)。下图显示图像采集15秒时的-ΔR/R图(触须刺激5秒)。结果显示通过刺激引起的血流动力学反应被观察到血管与背景的对比度更高,相应地,由于激活,桶皮质的总血红蛋白(充血)局部增加。在IOSI结果的指导下,在桶皮质(R1)和对照区(R2)进行了八次毛细管速度扫描。图4(B)-(E)显示了这两个区域在不同状态下的毛细管速度图。绘制了速度信号的直方图分布图,以比较与休息和刺激的差异。在R1中,如图(D)所示,RBC速度在统计上增加,使得刺激状态的分布稍微向右倾斜。这也符合图4(C)中的观察结果,其中一些速度信号在触须刺激期间被增强。相反,对照区(R2)的两个分布大部分是重叠的图4(G),刺激后没有观察到分布位移。
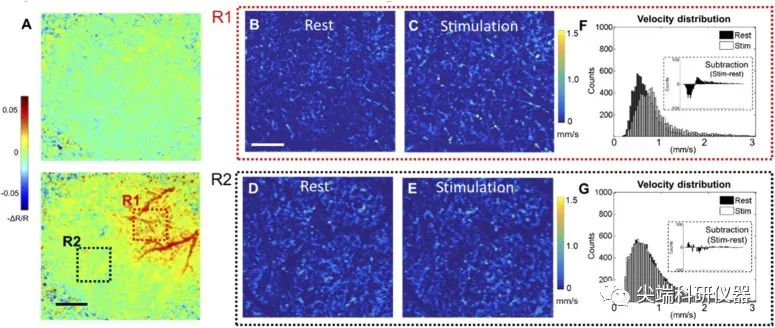
图四:A) IOSI刺激小鼠触须过程中桶状皮质的宽场反射图。上图:2秒数据采集(无刺激)。下图:15秒数据采集(5秒触须刺激)。R1表示触须刺激时血流动力学反应激活,R2为未观察到反应的对照区。比例尺代表1 mm。B) -E)是不同状态下两个区域的三维测速数据集的EN-FACE面AIP图像。在遮盖大血管后,在300µm厚的平面内生成图像,剩余的毛细管速度信号用F(R1)和G(R2)的直方图分布绘制。分布直方图中的插图表示从刺激到休息的减法。比例尺为200µm。
好了,文章读到这里不知道大家有什么新的想法呢。小编觉得本文介绍的方法对清醒小鼠脑血流的光学成像具有很大指导意义,有望为清醒行为动物的实验开辟新的视野,以进行脑功能和药物开发的基础研究。今天就到这里吧,欢迎有对OCTA技术感兴趣的老师们找我进行沟通咨询,让我们一起探索这奇妙的动物实验吧!
参考文献Li Y, Rakymzhan A, Tang P, Wang RK. Procedure and protocols for optical imaging of cerebral blood flow and hemodynamics in awake mice. Biomed Opt Express. 2020;11(6):3288-3300. Published 2020 May 26. doi:10.1364/BOE.394649
颅窗的建立和检测设备的搭建
首先作者在第0天通过异氟醚全麻对小鼠进行颅骨窗手术,然后在动物房进行手术恢复7天。在恢复期内,除了基本的术后监护和颅窗数码摄影外,没有进行任何影像学和训练。从第8天开始,每天将小鼠带回实验室,进行至少连续4天的处理和训练,以使其适应实验室环境、实验者和头部约束装置,老鼠在头部约束成像之前接受了额外的训练(详细见原文链接)。在研究的第12天开始进行第一次清醒成像,使用IOSI和OCTA进行头部约束成像所需的Z长时间为40分钟。为了进行演示,我们在老鼠身上执行了IOSI和所有三种OCTA协议,但是可以根据未来研究的目的选择性地执行这些协议。如果操作和训练良好,老鼠可以每天成像,长达4个月。在实验的Z后一天,老鼠被麻醉成像然后anlesi,或者在麻醉下直接anlesi。

图一:A) 实验时间线。B) 安装颅骨窗的脑部显微镜图像。C) 开颅手术的横断面解剖。D) 安装固定装置和颅窗后的显微镜图像。E) 颅骨植入物的示意图和尺寸。F) 从第0天到第14天颅骨窗的一系列显微镜图像。G) ,H)和I)头部约束装置的3步操作/培训。
在使用OCTA采集脑部血流信号的过程中,使用内部构建的双模光学成像平台。OCTA在小鼠脑组织中达到∼5.1µm的轴向分辨率和∼10µm的横向分辨率。并为样品提供2.22 mm的成像深度。下图为实验过程中示意图。

图二:A)光学成像系统的示意图。SLD:超发光二极管,PC:偏振控制器,PC(bold):个人计算机。B)鼠标触须刺激设置的示意图。C)和E)使用OCTA成像。D)和F)使用IOSI进行成像。
OCTA技术在清醒小鼠脑血流显像中的应用
在建立颅窗模型后第14天,作者使用OCTA扫描成像在清醒小鼠中获得了高分辨率的血管系统图像和血流灌注动力学图像。下图中的所有结果都是在清醒的小鼠处于静息状态(无刺激)时获得的。结果显示了小鼠脑部的三维血管系统的血管图像并获得了此范围内的断层图像,通过这些图像作者发现在皮质层上方生长着一层血管丰富的脑膜组织,这在之前的急性颅骨窗中没有发现。因此为了增强皮质血管系统的可视化,作者使用半自动分割软件将颅窗下的脑组织分离成脑膜层(L1)和皮质层(L2),如图3(C)中的黄色分割线所示。在去除L1中的尾随伪影后,生成新的正面投影图像图3(L2)。与图3(A)中的原始投影图像相比,L2的皮质血管系统可以得到更好的成像效果和对比度。之后作者又通过DOCTA对颅窗进行成像并进行血流检测,结果显示穿透小动脉(绿色)和上升小静脉(红色)的双向轴向速度,速度范围为6.1 mm/s至-6.1 mm/s如图3(D)。为了更准确地评估毛细管动力学,作者将直径大于15µm的较大血管进行掩蔽来去除信号。进一步处理的速度图如图3(F)所示。图3(G)和图3(H)中的横截面展示了掩蔽大流量信号前后的差异。

图三:A) 颅窗手术后第14天清醒小鼠静息状态下全深度3D-OCTA数据集的EN-FACE面Z大强度投影(MIP)。B) OCTA断层结构在图A中红色虚线位置的横截面。C)带有L1和L2黄色分割线的OCTA血流横截面。右侧显示了两个分割层的EN-FACE面图像。D) 利用三维DOCTA数据集的MIP生成双向轴向速度图。彩色条代表红细胞在±6.1 mm/s范围内从皮质表面下降(正,绿色)和上升(负,红色)的血流轴向速度。E) 和F)显示了300µm厚平面内3D毛细管速度测量数据集的平均强度投影(AIP),分别对应于它们的横截面G)和H)。此图中的所有比例尺代表500µm。
清醒小鼠触须刺激的血流动力学研究
接着作者使用IOSI揭示了清醒状态下小鼠桶状皮质神经活动引起的血流动力学变化。图4(A)上图显示了尚未触须刺激时,图像采集时的相对反射率(-ΔR/R)。下图显示图像采集15秒时的-ΔR/R图(触须刺激5秒)。结果显示通过刺激引起的血流动力学反应被观察到血管与背景的对比度更高,相应地,由于激活,桶皮质的总血红蛋白(充血)局部增加。在IOSI结果的指导下,在桶皮质(R1)和对照区(R2)进行了八次毛细管速度扫描。图4(B)-(E)显示了这两个区域在不同状态下的毛细管速度图。绘制了速度信号的直方图分布图,以比较与休息和刺激的差异。在R1中,如图(D)所示,RBC速度在统计上增加,使得刺激状态的分布稍微向右倾斜。这也符合图4(C)中的观察结果,其中一些速度信号在触须刺激期间被增强。相反,对照区(R2)的两个分布大部分是重叠的图4(G),刺激后没有观察到分布位移。

图四:A) IOSI刺激小鼠触须过程中桶状皮质的宽场反射图。上图:2秒数据采集(无刺激)。下图:15秒数据采集(5秒触须刺激)。R1表示触须刺激时血流动力学反应激活,R2为未观察到反应的对照区。比例尺代表1 mm。B) -E)是不同状态下两个区域的三维测速数据集的EN-FACE面AIP图像。在遮盖大血管后,在300µm厚的平面内生成图像,剩余的毛细管速度信号用F(R1)和G(R2)的直方图分布绘制。分布直方图中的插图表示从刺激到休息的减法。比例尺为200µm。
好了,文章读到这里不知道大家有什么新的想法呢。小编觉得本文介绍的方法对清醒小鼠脑血流的光学成像具有很大指导意义,有望为清醒行为动物的实验开辟新的视野,以进行脑功能和药物开发的基础研究。今天就到这里吧,欢迎有对OCTA技术感兴趣的老师们找我进行沟通咨询,让我们一起探索这奇妙的动物实验吧!
参考文献Li Y, Rakymzhan A, Tang P, Wang RK. Procedure and protocols for optical imaging of cerebral blood flow and hemodynamics in awake mice. Biomed Opt Express. 2020;11(6):3288-3300. Published 2020 May 26. doi:10.1364/BOE.394649
相关产品
-
- 动物光学相干断层扫描血管成像系统
- 品牌:英国Optoprobe
- 型号:OPTO


