| 行业应用: | 制药/化妆品 生物制药 |
#本文由马尔文帕纳科医药业务发展经理 韩佩韦博士供稿#
蛋白质的热稳定性研究对于加深对蛋白质的结构和功能的了解有着非常重要的意义。差示扫描量热技术(DSC)是直接测量热转变过程焓变(ΔH)的分析方法,例如蛋白质,核酸或其他生物多聚物的热变性过程,为表征蛋白质及其他生物分子的热稳定性建立“金标准”技术。
一、焓变对于蛋白质的稳定性意味着什么?
1,什么是焓(hán)变(ΔH)?
ΔH(焓变)是在恒压状态下将系统升高至温度T过程中摄取的总能量。对于蛋白质而言,这意味着用于使蛋白质发生去折叠所花费的能量(热量),此过程中 ΔH 是为正值,代表这是一个吸热过程。这种能量与蛋白质中所有原子和分子运动相关,以及维系蛋白质保持折叠构象中的键能。
通过将吸热谱图下方的面积进行积分(见图 1)可以计算得到焓变(ΔH)。焓变用每摩尔蛋白质的吸收的卡路里(或焦耳)来表示。由于蛋白质在 DSC 实验中暴露于升高的温度,因此蛋白质开始发生热变性,并伴随着非共价键的断裂。焓变(ΔH)与维系蛋白质天然(折叠)构象中所需的价键数量有关。焓变(ΔH)也取决于我们测量总蛋白质浓度的准确程度。如果蛋白质浓度不是很准确, 则会影响到计算出的ΔH值。
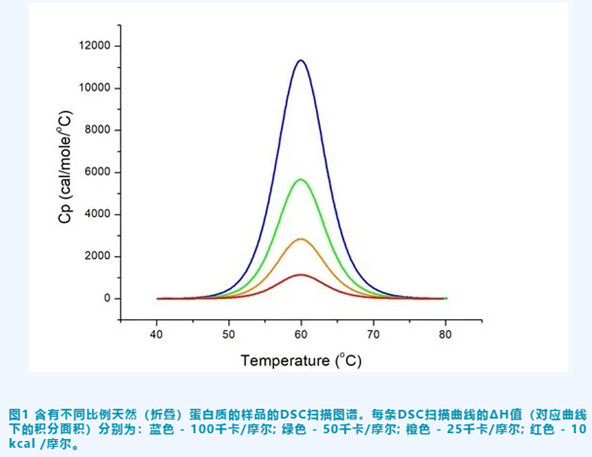
2,焓变(ΔH)值可以在实践中告诉我们什么?
当您比较不同蛋白质的DSC结果时,具有较大ΔH值的蛋白质不一定比具有较小ΔH的蛋白质更稳定。由于ΔH值会对蛋白质摩尔浓度归一化,因此该值通常与蛋白质的尺寸成比例。大多数蛋白质具有相同的键密度(单位体积内的价键数量),因此,期待具有较大分子量的蛋白质也具有较大的焓变(ΔH)值也是合理的。
3,焓变(ΔH)的决定因素是什么?
焓变(ΔH)取决于溶液中天然蛋白质的百分比。
一个非常重要的考虑是DSC仅测量初始处于折叠(天然)构象中的蛋白质的ΔH值。ΔH值取决于具有折叠(活性)构象的浓度。如果初始折叠蛋白质组分小于总蛋白质浓度(即活性浓度小于100%),则计算出的ΔH值将相应地变小。
下图显示了在储存期间的不同时间测量的相同蛋白质的DSC图谱。蓝色曲线图谱表示新鲜制备的蛋白质,是100%天然(折叠)蛋白质。当蛋白质样品在储存期间发生部分变性时,溶液中的天然蛋白质的比例开始下降,导致DSC图谱的焓变降低。当我们拥有100%天然蛋白质的参考DSC图谱时,我们可以根据不同状态样品的相对ΔH值来估计每个样品中的折叠蛋白质比例。
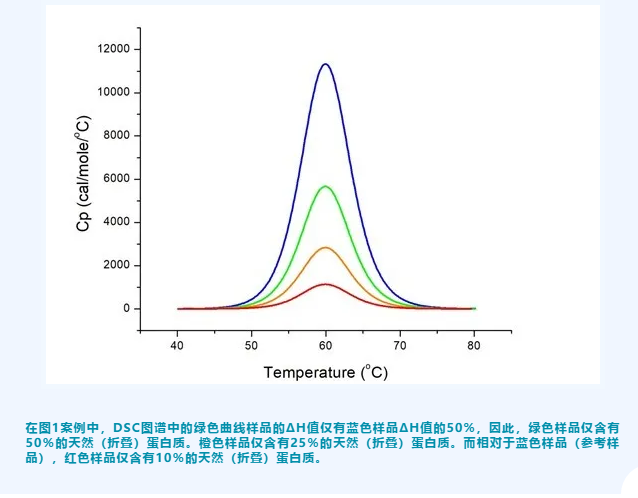
4,如何判断蛋白质是否失活?
到目前为止,我们已提及的焓变是指通过DSC仪器直接测量到的“热”焓,也就是热力学焓变,通常表示为ΔHcal,这是其他任何非量热技术,例如圆二色谱(CD),表面等离子共振(SPR)等技术不能获取的焓变量。
还有另一种其他技术可以获取的焓变类型,即范霍夫焓变 - ΔHVH,我们同样可以通过DSC数据计算得出。范霍夫焓变(ΔHVH)可从通过DSC非两状态模型(non-2-state model)拟合得到。
两种不同的焓变对蛋白质热稳定性的测定又有什么实际意义呢?
在DSC技术中,ΔHcal仅由DSC热转变峰曲线积分的面积来确定,而ΔHVH仅通过热转变峰曲线的形状来确定。转变峰形越尖锐,ΔHVH越大,反之亦然。ΔHcal是具有浓度依赖性的,但ΔHVH不是。
若ΔHcal/ΔHVH比例为1,通常意味着所研究的热转变状态符合两状态去折叠(Two-state unfolding model)模型。如果ΔHcal/ΔHVH比例大于1,则意味着存在显著密集的中间体存在; 而ΔHcal/ΔHVH比小于1,则意味着存在分子间相互作用。
使用ΔHcal/ΔHVH可以帮我们估测是否有很大部分蛋白质是失活的。如果我们有一个简单的单结构域蛋白质,并且假定没有中间体,则我们可以预测,其去折叠过程的ΔHcal/ΔHVH的比值不会远离1。因此,如果ΔHcal显著低于ΔHVH,可以表明很大部分蛋白质已经失活。
综上所述,对DSC中ΔH数据的分析可以让我们了解蛋白质的去折叠机制,以及多少蛋白质处于其活性的天然构象。
二、TM值如何与和蛋白质稳定性相关?
中点转变温度TM
我们可以从DSC数据中提取多个热力学参数,例如ΔH,ΔHVH(范霍夫焓变),ΔCP和ΔG,但最广泛使用的参数是TM。顺便提一下,这也是最容易和最准确的值 - TM是最大峰值所对应的温度。
“蛋白质稳定性”有多种定义。最常见的是,对于工业上有重要意义的蛋白质,该术语是指在生理温度下的功能(或操作)稳定性; 即,他们可以在37°C下发挥多长时间的生物功能?这可以通过需要花几天或数周时间的等温研究来评估,或者,如果使用差示扫描量热法(DSC),则可以在几分钟内变性蛋白质。
通过DSC获得的哪个热力学参数与功能稳定性相关度最佳?事实证明,是TM值。
热力学稳定性(ΔG)是功能稳定性的较差的预测因子; 技术上,ΔG仅适用于可逆去折叠过程,此外,它由TM,ΔH和ΔCP计算得到,后者可能很难获取。
一个例子是TM和ΔG与人肉杆菌蛋白抗原血清型C的半数聚集时间(half time)(作为功能稳定性的量度)的相关性,用作模型蛋白。ΔG与T1 / 2 agg. 相关系数(R)仅为0.4,而TM 与 T1 / 2 agg.的相关系数是0.92。(来自J Pharm Sci的数据,2011 Mar; 100(3):836-48)
思考TM的一种方式:
如下图所示,假设我们用 DSC 扫描两种不同配方中的蛋白质或两种不同的蛋白质构建体,则 TM 值向低温方向 5℃ 的负偏移(稳定性下降)实际上反映了在 37℃ 条件下的 Fu (蛋白去折叠比例)由2%增加到 3%。温度 T 下的 Fu 蛋白可以通过图像化的方式估算,即温度 T 以下的曲线下阴影区域面积和整个曲线下方面积的百分比。
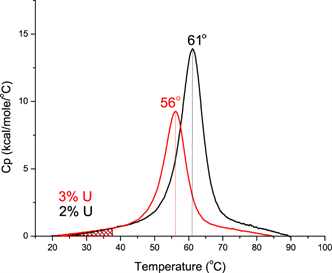
由于聚集体的生成可能是浓度依赖的过程,因此较高浓度的去折叠蛋白质(红色扫描曲线)将导致较快的聚合(更大组分的去折叠状态(U)才能转换为不可逆变性状态(I)。参见下面的原理图。
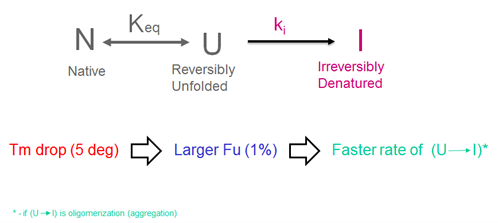
这种解析的一个推论是,曲线的整体形状应该是相似的。我们假定这种情况是对于在不同配方中的相同蛋白质或由一个母分子衍生出来的具有相似构建体的蛋白质。但是,对于完全不同的蛋白质,使用TM值作为用于稳定性比较的预测指标则应该谨慎使用。
扩展阅读(www.malvernpanalytical.com)
Differential Scanning Calorimetry (DSC): Theory andpractice
Differential Scanning Calorimetry (DSC) forBiopharmaceutical Development: Versatility and Power
The Power of Heat: Digging Deeper with DifferentialScanning Calorimetry to Study Key Protein Characteristics
PEAQ-DSC 微量热差示扫描量热仪:DSC

差式扫描量热法(DSC)是一种直接分析天然蛋白质或其他生物分子热稳定性的技术,无需外在荧光素或者内源荧光,它通过测定在恒定的升温速率下使生物分子发生热变性过程中的热容变化来实现。
马尔文帕纳科 MICROCLA PEAQ-DSC 微量热差示扫描量热仪能够帮助用户快速确认维持高级结构稳定性的最佳条件,提供简介、无缝的工作流程和自动化批量数据分析,其所提供的热稳定性信息被业内视为“金标准”技术,是一种非标记、全局性的数据。
关于马尔文帕纳科
马尔文帕纳科的使命是通过对材料进行化学、物性和结构分析,打造出更胜一筹的客户导向型创新解决方案和服务,从而提高效率和产生可观的经济效益。通过利用包括人工智能和预测分析在内的最近技术发展,我们能够逐步实现这一目标。这将让各个行业和组织的科学家和工程师可解决一系列难题,如最大程度地提高生产率、开发更高质量的产品,并缩短产品上市时间。
联系我们:
销售热线: +86 400 630 6902
售后热线: +86 400 820 6902
联系邮箱:info@malvern.com.cn
官方网址:www.malvernpanalytical.com.cn


马尔文帕纳科
仪器网(yiqi.com)--仪器行业网络宣传传媒