| 行业应用: | 仪器仪表 仪器仪表 |
今年 2 月,国家药品监督管理局发布了《中国医疗器械标准管理年报(2023 年度)》,截至 2023 年 12 月 31 日,现行有效医疗器械标准共计 1974 项。自新修订的《医疗器械监督管理条例》出台以来,医疗器械各类标准不断推陈出新,以《医疗器械生物学评价》(GB/T16886) 为例,近两年来多个分项陆续更新,在医疗器械材料的化学表征、降解分析、生物相容性和生物安全性方面做了更细致科学的规定,这也给医疗器械分析技术带来了更高要求。
从产品研发到生产质控,医疗器械的整个周期都离不开各种分析技术的保驾护航。安捷伦作为生命科学和化学分析领域的领军者,为医疗器械行业提供了全方位的整体解决方案,助力医疗器械行业蓬勃发展。
医疗器械的材料表征与分析
《医疗器械生物学评价 第 18 部分 风险管理过程中医疗器械材料的化学表征》(GB/T16886.18) 中对材料表征提出了指导和要求。通过材料表征,可以全面了解医疗器械材料的物理、化学和机械性能,以及材料对环境因素的耐受性,对于确保医疗器械的安全性、有效性和质量可控性具有至关重要的意义。
针对不同材料所需的研究项目和分析技术不尽相同。下图是由安捷伦液相色谱+多角度光散射检测器(MALLs)系统进行的透明质酸样品检测,涉及摩尔质量分布与累积分布等结果。

由于医疗器械材料的类型各异,相关的分析项目和技术手段也不胜枚举。例如金属材料或生物活性陶瓷等无机非金属材料的表征,则离不开原子吸收光谱仪(AAS)、电感耦合等离子体质谱仪(ICP-MS)等元素分析仪器,高分子聚合物材料则需通过液相色谱/体积排阻色谱进行分子量和残留单体的检测等。更详细的分析技术及案例分享,请关注后续安捷伦医疗器械方案的系列推文。
医疗器械的研发
有了合适的材料,下一步我们就步入医疗器械产品的研发了。这一环节中广受行业关注的,就是众多医疗器械报批时都需要的可沥滤物与可浸提物(Extractables and Leachables, E&L)分析。
国家药品监督管理局医疗器械技术审批中心发布了《医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则》和《医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则》,以帮助指导 E&L 实验室的工作。安捷伦也根据国标与指导原则的要求,整合了 E&L 分析多平台综合解决方案,使您“拿来即用”,快速获得针对 2000 种风险有机化合物及无机元素的高效筛查和快速定性定量分析能力。

在生物相容性与生物安全性方面,安捷伦可提供酶标仪、成像系统、流式细胞仪、实时抗阻分析系统等多款仪器,为遗传毒性、致癌性和生殖毒性等方面的研究提供多维度多视角的组合分析方法。

医疗器械的生产制造与质量控制
产品研发成功,进入生产环节,我们的关注点也转移到了如何进行质量控制,以保障产品的安全性和有效性。环氧乙烷残留量的测定,是众多使用环氧乙烷灭菌的医疗器械产品必备的质控环节。按照《医用输液、输血、注射器具检验方法 第 1 部分:化学分析方法》(GB/T14233.2-2022) 及《医疗器械生物学评价 第 7 部分:环氧乙烷灭菌残留》(GB/T 16886.7-2015),需要使用气相色谱技术对环氧乙烷和 2- 氯乙醇残留量进行测定。
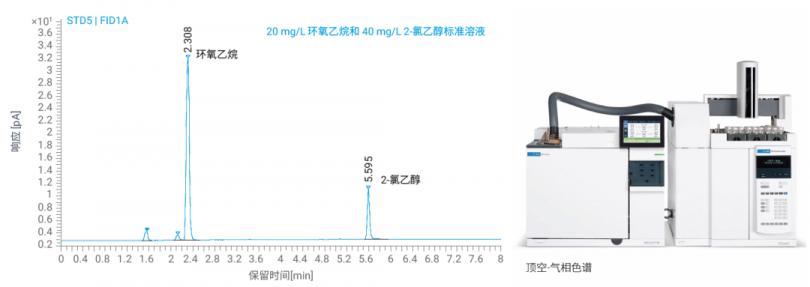
为全线赋能医疗器械行业的高质量发展,安捷伦充分发挥产品线长、应用范围广的优势,推出了医疗器械整体解决方案,覆盖了色谱、光谱、质谱等化学分析仪器,及酶标仪、流式细胞仪等生命科学分析仪器涉及的分析任务,以满足医疗器械领域广泛多样和快速发展的分析需求。
如需获取《安捷伦医疗器械完整解决方案》的介绍,扫描下方二维码即可获得:




安捷伦科技(中国)有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒