| 行业应用: | 制药/化妆品 生物制药 |
一次性使用产品应用
了解一次性冻存袋中的颗粒物
一次性冻存袋与USP第<788章>的关系
作者:Michael W. Johnson
生物制药行业面临着诸多挑战。经济变化、不断增加的医疗成本、即将到期的专利以及日益个性化的医疗都影响着制造商处理生物工艺步骤的方式以及用于制造生物药物产品的设备和系统(1)。对更小的批量尺寸、更大的工艺灵活性、更低的制造成本以及更快的临床速度的需求推动了该行业对一次性产品(SUS)的需求(图1)。SUS供应商已经迅速开发了配件、管道、泵、传感器和柔性包材等组件,这些组件经过预灭菌交付给用户,可在单个工序或工艺步骤中使用。
缓冲液制备和介质储存等应用率先采用一次性组件,包括过滤截留和塑料生物容器。随着一次性技术被大众接受,一次性生物反应器和混合系统的实施,它进入了上游工艺。SUS的新应用是在下游工艺,如药物储存和zui终罐装(2)
一次性系统的好处已经经过很彻底的研究。与传统的多用途系统相比,具有一些很关键的优势:减少资本支出;更小、更灵活的制造工艺;消除昂贵的在线清洗(CIP)和在线蒸汽灭菌(SIP)工艺;减少交叉污染;并促进流程转换。伴随着这些优点,对聚合物材料和一次性系统相关的注领域也随之备受关注。
图1 驱动SUS发展的优势
SUS一个值得关注的领域是其清洁度。因为它们是按“原样”使用的,因此,对其清洁度的要求已经从Z终用户转移到供应商。存在于特定系统中的污染物——如可浸出化合物或颗粒物质——可能会转移到工艺介质中。上游SUS过程(如生物反应器和混合系统)中的污染物风险较小,因为工艺流体将经历下游过滤和净化步骤,这可以从工艺流中去除这些污染物。SUS越接近Z终药品,就越需要减少其可浸出物和颗粒。显然,原料药储存和Z终罐装等Z终工艺步骤是高风险活动,需要SUS具备Z低水平的可浸出物和颗粒。
粒子源
颗粒物可以有许多不同的来源。一个来源是药品生产的环境:例如,供暖、通风和空调(HVAC)系统;设施中使用的工具和设备;以及支持制造过程的人员。在整个过程中用于包装、混合、纯化和运输介质的组件和系统是另一个颗粒来源。它们包括垫圈和密封件、小瓶和注射器,以及构成SUS的组件,如管子、配件和袋子。
更好地了解和控制SUS中颗粒是为了减少其临床影响并确保患者安全。如果与生物疗法一起注入,颗粒物会阻塞血管,影响功能性身体系统,导致组织损伤甚至内脏衰竭。颗粒也可能与患者的动脉系统不相容,本质上会毒害他/她。其他潜在影响包括免疫系统负担过重和降低药物疗效。决定药品中的颗粒是否会影响患者的因素包括存在的颗粒的大小、形状和数量;这些颗粒的组成;给药的剂量、频率和途径;以及患者属性,如年龄和健康状况(3)。
除了可能的临床影响外,次要的是商业影响。颗粒物可能导致产量降低和批次报废。销售商品成本(CoGS)也受到负面影响,随之增加对更多风险缓解措施和质量保证(QA)检查的需求。此外,公司可能会受到监管机构越来越多的审查。在Z近的一起事件中,19批药品因在小瓶中发现玻璃颗粒而被召回(4)。即使在美国食品和药物管理局(FDA)发出了几封警告信并且完成了多个设施的昂贵升级之后,这种情况仍然发生(4)。
为了不断努力减小颗粒,几个监管小组已经制定了标准,这些标准由这些小组不断审查和更新。表1是此类标准的部分列表。一个常用的标准是USP788,该章建立了定量检测颗粒的方法,并为进样中的颗粒提供了可接受的限值。USP 788 中规定的限值取决于所使用的方法(光阻法或显微计数法)以及样品是大容量 (>100 mL) 还是小容量 (≤ 100 mL)。表2 列出了这些限制 (5)。
监管标准侧重于Z终药品的质量和颗粒含量,而不是用于制造这些药物的组件和设备。填补颗粒源空白的是行业组织,如美国机械工程师协会生物工艺设备组(ASME-BPE),生物过程系统联盟(BPSA),国际制药工程师协会(ISPE)和注射药物协会(PDA)。2012 年 ASME-BPE 生物工艺设备标准 (6) 于 2014 年更新,增加了关于一次性组件中颗粒物的部分。同样,BPSA正在编写一份白皮书,该白皮书将解决一次性工艺设备中颗粒的控制,测试和评估问题。



材料和方法
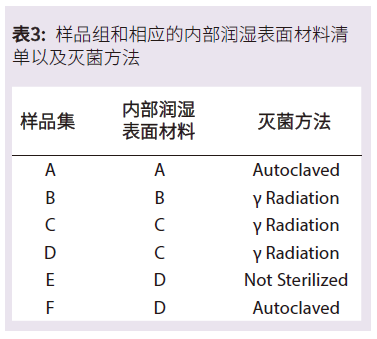
为了更好地了解SUS对药品颗粒含量的潜在贡献,我们评估了几种不同的一次性袋子,以量化每种袋子中存在的颗粒数量和大小。我们从五个不同的制造商那里选择了六种不同的 1L的 2D袋子进行本次评估。
这六套袋子包括四种不同的基础聚合物材料,用于其内部润湿表面。6例中有3例进行了伽马辐射灭菌,2例进行了高压灭菌,1例在没有灭菌的情况下进行了评估(表3)。


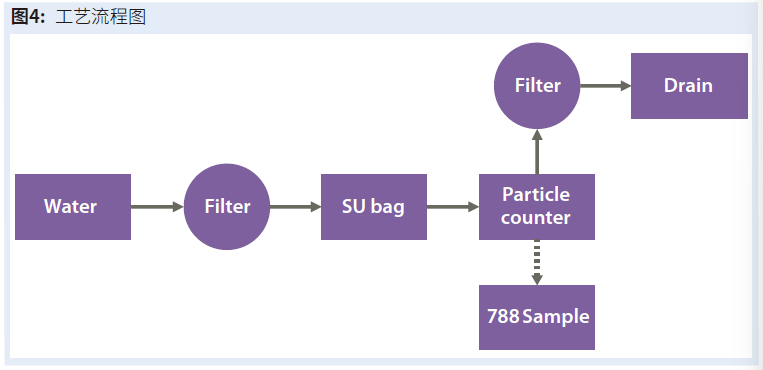
我们使用在线粒子监测系统来测量样品中的粒子。它使用高强度照明来照亮流动池液体流。在照明系统的流体流对面是一个实时电荷耦合器件(CCD)相机,它可以创建流动液体流的连续高质量数字图像。然后,专有软件分析每张图像,将其分解为单个像素。穿过流动池的粒子在每张图像中显示为暗像素(图2)。该软件计算每个粒子的长轴和短轴、标称直径和周长(图3)。根据它们的标称直径,粒子被分配到尺寸箱中,每个箱都随着流体通过流动池的体积而被记录。对于这项分析,我们将视觉系统的检测限设置为0.7µm,因此它只计算那些≥0.7µm的粒子。
“过程图”框列出了用于测试每个样品袋的步骤(图4)

结果
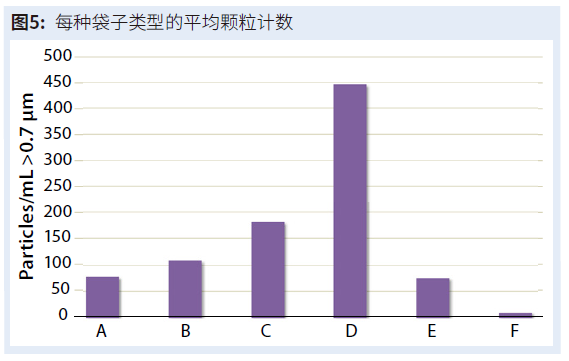
图5显示了每个样品组的三个重复袋中每毫升中存在的平均颗粒。 数据范围从袋组 F 的低 10 颗/mL 到袋组 D 的高 447 颗/mL。将每个袋子的总体积乘以其颗粒浓度,总颗粒计数范围为 10,000 颗/袋(袋组 F)到 447,000 颗/袋(袋组 D)。袋组 A、E 和 F 通常具有 <100 颗/mL;袋 B 和 C 均具有 <200 颗/mL;袋组 D 超过 400 颗/mL。

图6显示了我们评估中每个袋子的颗粒浓度,以及符合USP 788标准的类别的颗粒尺寸范围的细分。数据还显示了批次内的变异性。虽然两个袋子(D2和D3)在10μm至25μm范围内具有高颗粒浓度,但这些数据表明,在一次性袋子中发现的大多数颗粒尺寸为<10μm。
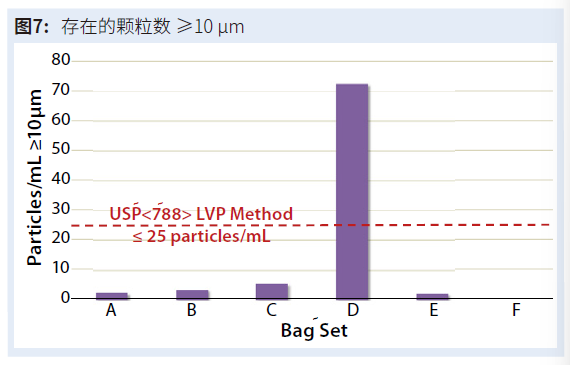
图7显示了每个袋组的≥10μm平均颗粒浓度。这些结果表明,每个袋子都能够满足USP 788的要求,该要求规定大容量肠外药物产品(>100 mL)中≥10μm的颗粒不能超过25颗/mL。图表上的红色虚线标示了该限制。将其应用于每个袋子组表明,只有袋子套装 D 不满足USP 788中规定的限制。
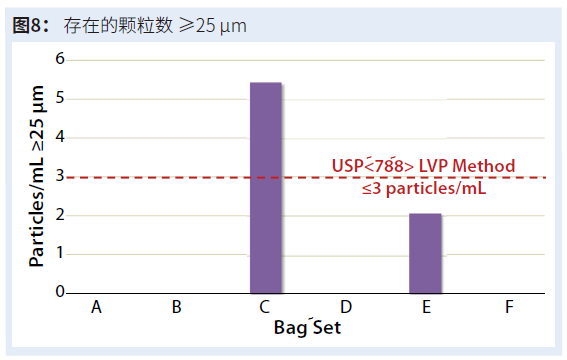
接下来,我们对大容量肠胃肠外药物应用了第二个USP 788颗粒限值。它规定≥25 μm尺寸的颗粒不得超过 3 颗/mL。我们的测试数据(图8)显示,六个袋子中有五个符合USP 788标准,其中袋C超过了限制。
为了将我们的数据与对Z终药物产品的影响相关联,我们从每个袋子的流出液流中提取两个 50 mL 样品,然后合并并将这些样品提交给实验室进行检测,根据 USP 788 方案进行测试。使用光阻法对它们进行评估,应用大容量肠外溶液的标准。表4总结了该分析的结果,表明从所有六个袋子中提取的样品都符合USP788的验收标准。
Z后,表5总结了我们的一次性袋子颗粒数据。它记录了材料和灭菌方法的样品设置变量、视觉系统结果所示的在线颗粒浓度、由 USP 788光阻法确定的颗粒浓度,以及每个样品的颗粒浓度是否通过 USP 788 标准。
不断发展的知识集
随着生物工艺行业和SUS的使用不断适应和发展,监管机构不断完善相关标准,SUS的颗粒贡献将成为人们日益关注的焦点。我们评估的目的是了解一次性袋子中颗粒物的现状及其与USP 788的关系。
我们的结果表明,来自不同供应商的一次性袋子中的颗粒浓度范围很广,并且批次内存在不一致。在我们测试的 18 个袋子中,大多数颗粒的大小为 <10 μm。 当我们对在线颗粒数据应用USP 788验收标准时,六个袋子中的两个未能达到验收,而所有离线遮光样品都通过了注射剂规定的验收标准。此外,在线流式细胞分析方法显示每个样品组的颗粒浓度高于光阻法方法,在某些情况下差异超过10×。
对于Z终用户,仅根据特定应用的需求及其验收标准来确定与这些袋子中测量的颗粒浓度相关的风险水平。对于整个行业来说,我们必须努力更好地了解影响Z终药品中颗粒物的因素。其中之一可能包括灭菌方法对微粒的影响:暴露于伽马辐射灭菌的三套袋子具有三种Z高的颗粒浓度。结构材料是进一步研究的另一个因素:显示Z高颗粒浓度的两个袋子组是使用相同的聚合物构建的,用于其内部润湿表面。
我们都必须继续量化完整SUS中的颗粒水平并建立适当的控制步骤。这将有利于整个行业的健康,并将SUS用户的风险降至Z低,Z终也将降低患者的风险。
引用
1 Freissmuth J. Facing the Pharmaceutical Future. Pharm. Manuf. February 2013.
2 Martin J. Single-Use Technology. BioProcess Int. 8(6) 2010: 64–65.
3 Langille SE. Particulate Matter in Injectable Drug Products. PDA J. Pharm. Sci. Tech. 67, 2013: 186–200.
4 Palmer E. Hospira Blames Supplier’s Bad Vials for Latest Recall. Fierce Pharma Manuf. 16 July 2012.
5 Chapter <788> Particulate Matter in Injections Standard. US Pharmacopeia– National Formulary 2011.
6 Standard BPE-2102. Bioprocessing Equipment. American Society of Mechanical Engineers: New York, NY, 2012.
Michael W. Johnson是 Entegris, Inc. 的生物工艺应用经理,地址为 3500 101 Peavey Drive, Chaska, MN 55318;1-952-556-4085;mike_ johnson@entegris.com。Entegris 是 Entegris, Inc. 的注册商标,ASME 是美国机械工程师协会的注册商标。ISPE是国际制药工程学会的注册商标。






上海奥法美嘉生物科技有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒