| 行业应用: | 仪器仪表 仪器仪表 |
1、简介
高浓度制剂是指Z 终的单抗蛋白浓度大于100 mg/mL的制剂。目前,FDA批准的单抗产品中有大约三分之一是高浓度制剂(>100mg/mL)。[1]高浓度制剂可降低西林瓶的灌装体积,节约生产成本,减少注射时间,提高患者依从性。
注射剂中的颗粒检测是注射剂质量控制的重要项目,影响着注射剂的安全性及有效性。颗粒主要包括可见颗粒和亚可见颗粒(sub-visible particle,SbvP),美国药典USP<788>和中国药典CP0903中均对注射剂亚可见颗粒(不溶性微粒)的检测方法和限度进行了明确的规定。针对抗体注射剂,美国药典USP<787>和USP<1787>对其亚可见微粒进行了补充说明。
与常规注射剂相比,高浓度抗体药物制剂具有注射体积小(通常为2mL)[2]等特点,现有检测方法在检测小容量的单剂量包装样品具有一定的局限性;高浓度抗体药物制剂的理化性质相较于常规注射液也出现了变化,蛋白质浓度的增加使短距离相互作用的影响越来越大,蛋白质-蛋白质相互作用变得显著,增加了制剂的黏度。黏度、流动性差等特点使其在亚微粒检测混合和抽取时有一定影响;由于高浓度抗体制剂的分子间结构更加复杂,更易产生自缔合(Self- association)和聚集(Aggregation),相较于常规SbvP检测的光阻法,流动成像法因可区分某些类型的颗粒而广泛应用于聚集体的检测。
2、颗粒来源及检测方法
高浓度抗体药物制剂的颗粒来源主要有三类:
1)外源性颗粒,指与生产工艺及产品成分无关的颗粒;
2)内源性颗粒,来源于生产原料、包材以及生产工艺的操作中所产生的亚可见微粒,如胶塞上脱落的碎片、预充针的硅油涂层和玻璃碎片等;
3)固有性颗粒,即产品自身产生的颗粒,如蛋白聚集与表面活性剂胶束形成的颗粒。
由于存在多种潜在的颗粒来源,因此识别颗粒并确定颗粒来源有利于产品开发和应用评估。如果研发时测试结果与标准限度出现偏差,颗粒识别将指导原因分析、风险评估、纠正措施、调整控制策略等多个环节。[3]
美国药典推荐使用光阻法作为检测抗体注射剂中不溶性微粒的检测的首 选方案[4],相较于常规的注射剂,高浓度抗体注射剂在使用光阻法需注意:
1)粒度分布的分析取决于所使用的仪器及其校准方法,目前常用于校准的标准粒子均为球体,但蛋白质颗粒通常具有不规则的形态,等效球体模型下可能会对蛋白质粒径检测有一定的影响。
2)小体积检测分析方法开发
高浓度抗体注射剂具有注射体积小的特点,无法直接用于常规仪器的检测,需将几个样品混合获得可供测试的样品,美国药典USP<788>规定需混合得到25ml的样品,每次取样5mL,共检测4次,统计≥10μm 和≥25μm的颗粒浓度,舍去第1次测定结果,取剩下3次测定结果平均值为Z 终结果。
此外美国药典USP<787>中专门针对治 疗性蛋白质注射剂和相关制剂进行了补充说明,允许使用较小的测试产品体积来进行不溶性微粒的检测。对于没有足够体积的产品,可将适当数量的产品混合在一个单独的容器中,以获得单次测试所需的体积(通常为0.2-5.0 mL)。AccuSizer A2000 系列仪器可以提供小体积检测方案,以下检测方案仅供参考:
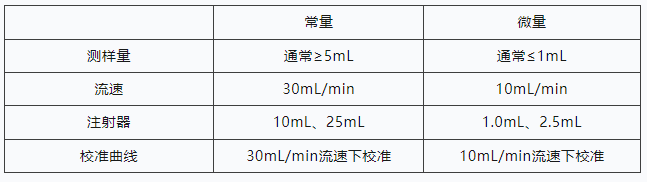
通过与常规检测方法的对比,我们建议在小体积检测分析方法开发上可进行如下改进:①使用微升级别进样量、降低流速;②使用小体积注射器,保证体积精度;③重新校准曲线保证数据精确度。
3)大多数高浓度抗体药物需冷藏储存,如采用较低温度直接检测,与管路中残留不同温度液体间将发生热量传递,造成液流紊乱;
4)中美药典均为≥10μm和≥25μm的颗粒制定了明确的标准限度,对于分子量较大的蛋白质药物,分子聚集之后产生的颗粒在免疫学方面存在隐患。Carpenter等人认为0.1-10μm 范围内的蛋白质不溶性微粒潜在免疫原性风险存在不确定性,测量 <10 μm尺寸范围内的不溶性微粒物有助于产品开发和表征。[5]
3、现行光阻法的优化方案
仪器优化设计[6]:光阻法颗粒计数仪器可通过仪器设计满足不同的应用目的。
1)如果在检测器流通池不变的基础上减少测样体积,可通过如下方式:
取样针的内径变小
取样针的长度变短
减少取样针尖与测样容器底的距离
取样针为平头型设计
软件中支持设置不同取样体积,即包括Z 低取样体积
支持基于取样针中心点的平底容器的倾斜放置样品固定模块
2)如果要减少测样过程中气泡的产生,设计如下
可调节抽取样品速度
平头取样针
测样流通池孔径小于取样针的内径
AccuSizer A2000 系列不溶性微粒检测仪,采用PFA材质进样管,进样管管内内径可选,长度可调,可使用平头取样针,可用于不同规格的试剂瓶,软件可以调节不同的进样体积,近透明的材质更方便观察是否抽取到气泡。
A2000 系列单个传感器检测范围为:0.5μm~400μm,传感器浓度上限10000个/mL,具有512数据通道,分辨率高。模块化设计,维护升级便利,如样品检测量多,可选配自动进样器,可实现全自动进样。

图1 AccuSizer A2000 系列不溶性微粒检测仪
4、新型SbvP检测方法
不溶性微粒的来源有多种,分辨微粒的来源有利于开发和应用的控制策略,但常规SbvP检测的光阻法无法辨别不溶性微粒的形态,无法确定微粒的来源。2017年USP40<1788>收录不溶性微粒检测第三法——流动成像法(Flow Imaging method, FIM),流动成像法结合微流体和光学显微镜技术,可快速大量地自动捕捉图像,这些图像可以用来分析生物治 疗样品中颗粒的浓度、大小分布及形态。
聚集蛋白具有半透明、折光率低等特点,在使用光阻法(Light Obscuration method, LO)进行不溶性微粒测试时,可能无法检测出透明度较高、对光不敏感的蛋白粒子。对于聚集蛋白,流动成像法获得的粒子浓度将比光阻法获得的粒子浓度更准确[7]。但光阻法仍然是评估颗粒负荷的一个重要工具,因为:
1. 光阻法仪器具有高可靠性和可重复性;
2. 对非美国市场的监管要求可能需要使用光阻法;
3. 药品的光阻法测试有悠久的历史和重要的积累的经验,测量的颗粒浓度的历史值很容易与当代的光阻法测量值进行比较。
综上所述,采用光阻法为主,流动成像法为辅的不溶性微粒检测方法更有利于产品的开发和质量监控。
FlowCam8000系列流式成像颗粒分析系统
流式成像颗粒分析系统(FIM)将数字成像、流式细胞技术和显微镜的优势结合在单个解决方案中。除了测量传统的粒子大小和数量,通过分析图像还可以表征生物药品、蛋白样品、注射液、细胞、浮游微生物等中的亚可见颗粒(不溶性微粒)。

图2 FlowCam 8000 流式成像颗粒分析系统
5、在药品全生命周期中对SbvP进行监管
早期研发阶段和后期工艺阶段可使用多种检测方法对颗粒进行全面的表征分析,对比不同方法间差异性,监控颗粒的形成途径,来源及变化趋势,为处 方工艺开发提供参考;
后期研发阶段的重 点是了解产品不同批次之间的可比性,以及颗粒结果与配方、制造和使用等因素之间的关联性,如应监测临床批次1~100 μm范围内的颗粒数量与大小;应收集在储存、使用和压力条件下形成的不溶性微粒物的定量和定性数据,并制定风险控制策略;在Z 终选择监测产品颗粒大小和计数的方法时,应分别建立内源性颗粒、外源性颗粒及固有性颗粒的控制策略。
药典的监控标准是Z 低标准,与对微粒危害的Z 新认识和监测需求相比具有滞后性,因此,在内控时也应尝试从多种粒径水平、多种检测方法对颗粒进行全面表征和分析,积累数据,以便为增加放行方法和提升放行要求提供依据,也为不良反应原因回溯提供数据支持。[8]如下是SbvP在产品生命周期内的检测策略,供参考。

表1 SbvP在产品生命周期内的检测策略[6]




上海奥法美嘉生物科技有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒