Milo单细胞Westernblot开启神经生物学研究新纪元
2020-02-175006神经系统(CNS)包含神经元和非神经元细胞,这些神经元和非神经元细胞协同工作以协调运动,处理感官信息并执行认知任务。CNS细胞均源自神经干细胞,先分化为神经祖细胞,继而发育为包括神经元,星形胶质细胞和少突胶质细胞等神经细胞亚型。
神经元既传输电信号又传输化学信号,可以分为三类:感觉神经元,运动神经元和中间神经元。星形胶质细胞是功能和分子上不同的神经胶质细胞,有助于神经递质的清除,维持血脑屏障以及突触传递的调节。它们还存储和释放葡萄糖,并促进少突胶质细胞的髓鞘形成活性。少突胶质细胞是另一种类型的神经胶质细胞,其主要功能是支持和隔离神经系统的轴突。有文章报道,这些亚型与诸如阿兹海默氏病,精神分裂症和多发性硬化症等神经退行性疾病和神经发育疾病中有密不可分的关系。
根据细胞形态识别出单个神经细胞,需要根据单个细胞中神经元谱系的蛋白标记物进行分类。然而,由于长轴突和卷曲树突的神经元形态复杂,使用传统的单细胞分析工具流式细胞术难以分析神经元。因为流式细胞术很难将信号与单个细胞体区分开。如果需要目标阳性细胞的百分比并进行统计分析,免疫荧光和其他单细胞成像技术也会带来挑战。
Milo单细胞Western平台能够鉴别并量化样品中神经细胞亚型的百分比,并基于亚型特异性标志物表达分析跟踪分化进程。在本文中,Milo单细胞Western平台动态检测诱导性多功能干细胞(iPSC)向神经元,星形胶质细胞和少突胶质细胞的分化过程。
技术流程
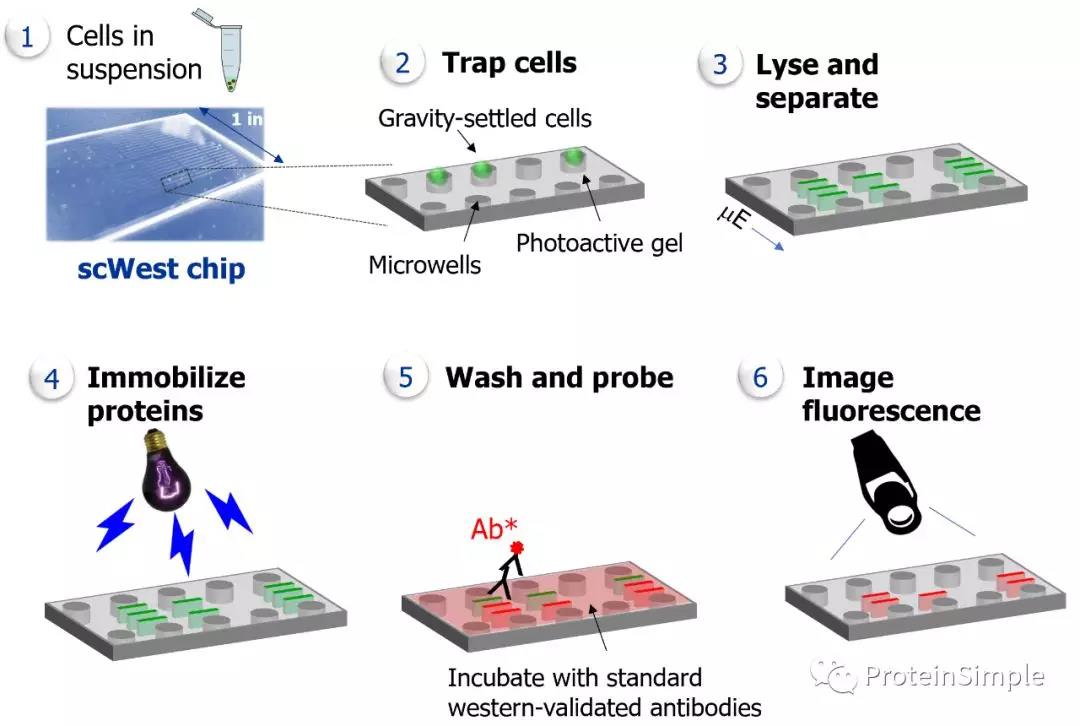
Milo在一项实验中可以测量数千个单细胞中,且多达12种蛋白质。因此可以快速识别样品中的细胞亚型。将IBJ6或IPSKiPSC在经Cultrex干细胞鉴定的生长因子(RGF)基底膜提取物(BME)包被的平板上培养,并保存在自制iPSC培养基中,该培养基包含研究级或GMP重组人FGFb,以及研究级或GMP重组人TGFb。每天更换培养基,然后将它们Z终分化为神经元,星形胶质细胞或少突胶质细胞,然后在Milo上进行分析(Figure 1)。

将神经细胞悬浮液加载到scWest芯片上,这样单个细胞就可以安放在芯片上的各个微孔中。然后Milo裂解细胞以产生单细胞裂解物,通过分子量电泳分离每个单细胞裂解物中的蛋白质,然后使用紫外线在scWest芯片中捕获蛋白质。然后,对目标蛋白进行一级抗体和荧光二级抗体进行免疫荧光捕获。通过使用开放格式的微阵列扫描仪对芯片进行成像,并使用Scout™软件对图像进行分析,以进行定量的自动数据分析。
研究数据
Milo识别异质神经细胞亚型
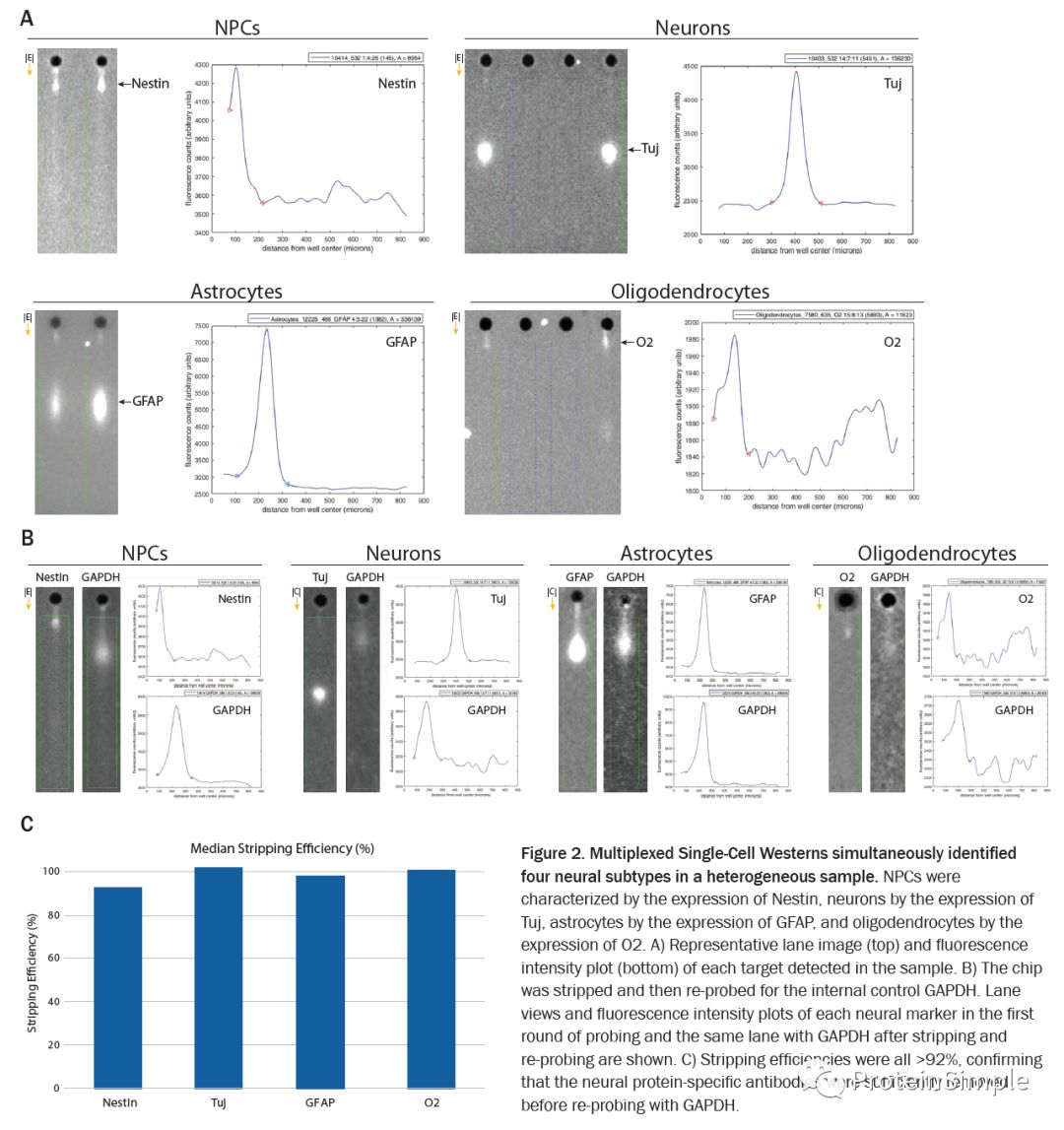
Milo单细胞Western多重检测法同时鉴定了每种分化的异质神经样品中的四种主要神经细胞类型(NPC,星形胶质细胞,神经元和少突胶质细胞),以及在原芯片上strip掉marker蛋白,重新进行了GAPDH的检测。Milo同时可以检测芯片的strip效率(剥离效率均高于92%)。
Milo定量神经组织中不同神经细胞数量及百分比
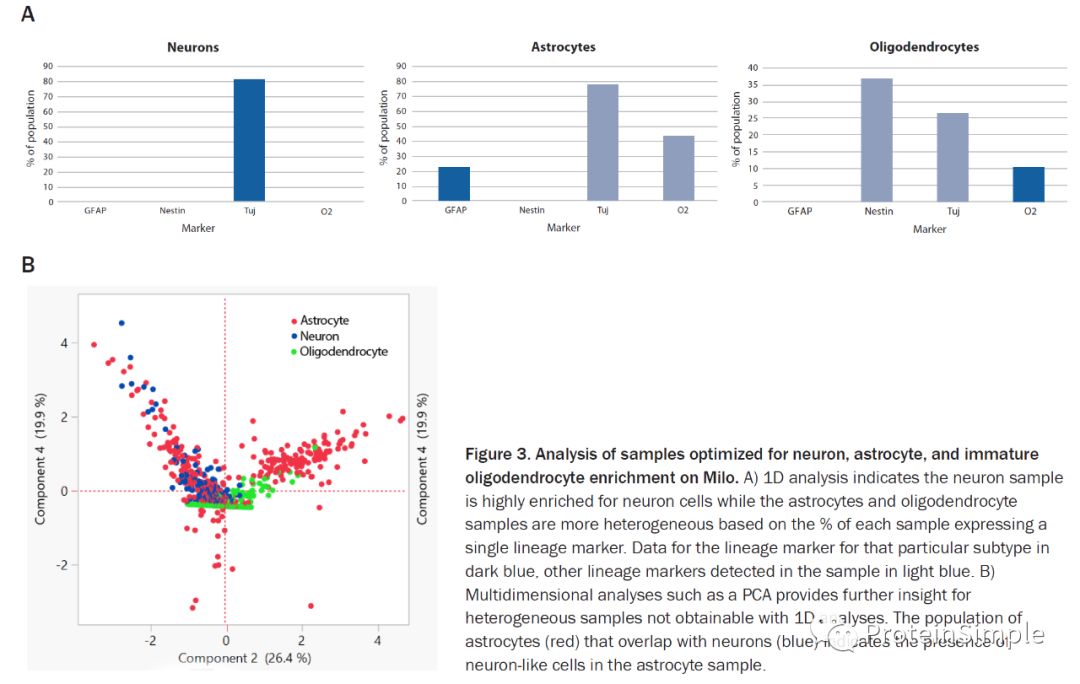
Milo可以对神经元,星形胶质细胞和少突少突胶质细胞进行一维分析:神经元样本中神经元细胞高度富集,而星形胶质细胞和少突胶质细胞样本的异质性则更高,基于每个样本中表达单个谱系标记物的百分比。该特定亚型的谱系标记数据为深蓝色,在样品中检测到的其他谱系标记为浅蓝色。利用多维分析(例如PCA),可以观察到与神经元(蓝色)重叠的星形胶质细胞(红色)表明星形胶质细胞样品中存在神经元样细胞。
Milo提供比免疫荧光更多的定量数据
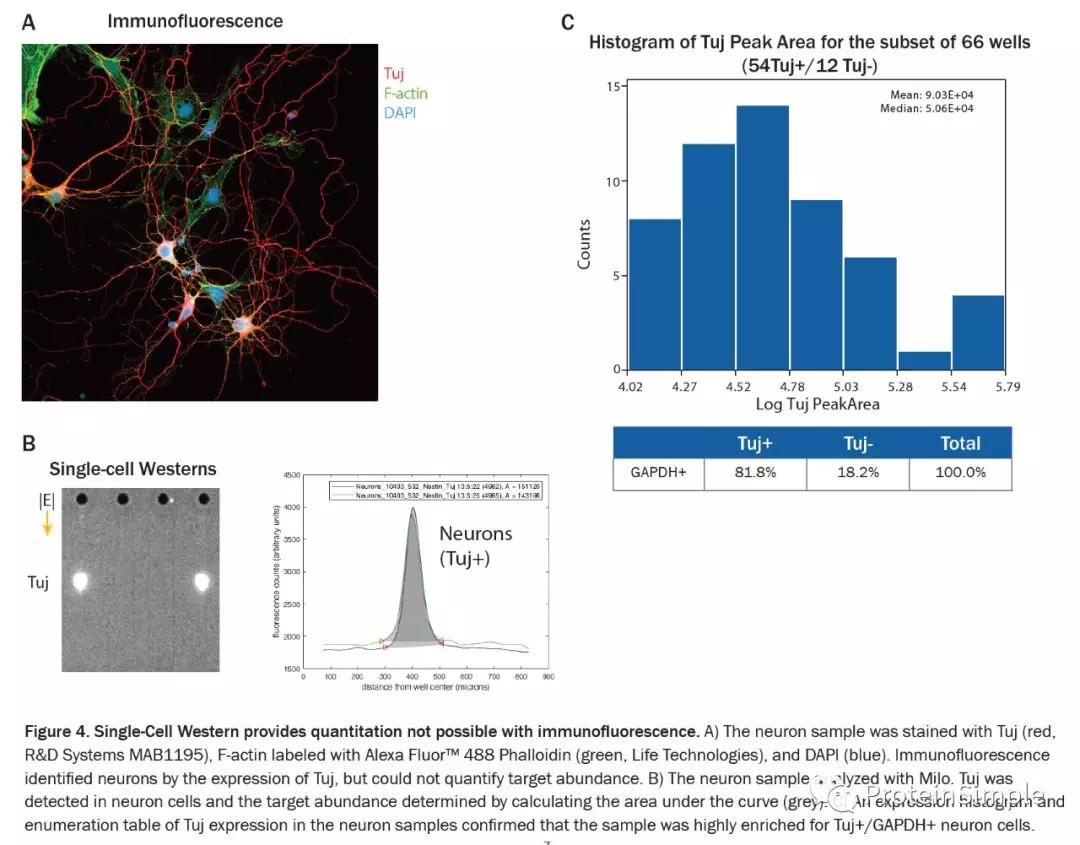
单细胞免疫印迹提供了免疫荧光无法实现的定量。免疫荧光可通过Tuj的表达鉴定神经元,但无法量化靶标丰度。Milo既可以在神经元细胞中检测到Tuj,并可以通过计算曲线下的面积(灰色)来确定目标丰度。结果证实神经元样品高度富集,使用scWest芯片分析的细胞中有81.8%表达了Tuj(Figure 4C)。此外,可以定量分析整个分析的单细胞中Tuj表达的异质性。
Milo跟踪GMP条件神经干细胞动态分化
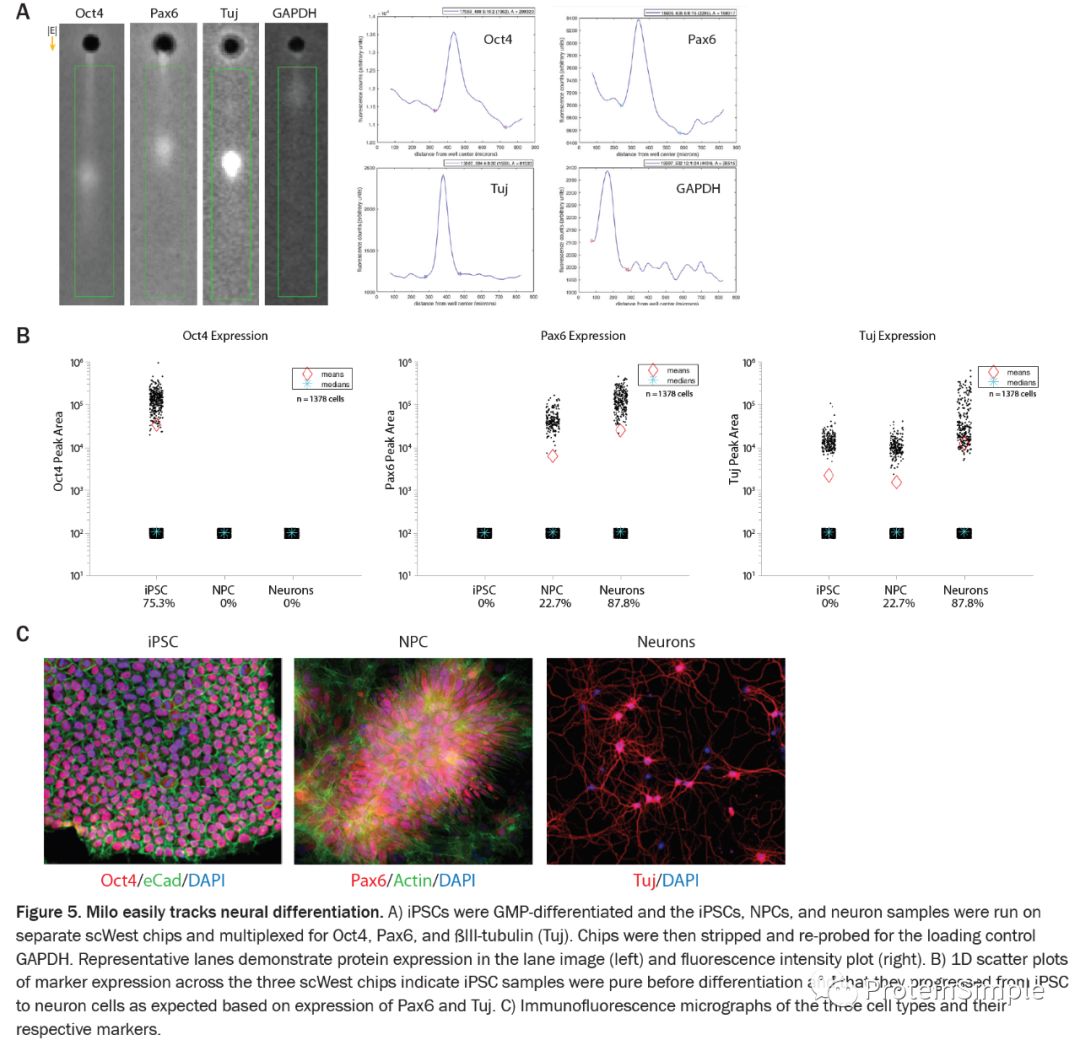
随着科学家和公司采用研究设计的分化方案并将其转变为可扩展,可再现且健壮的细胞疗法生产工艺,Milo可能成为一项至关重要的资产。在此过渡期间,科学家通常从研究级试剂升级到GMP级试剂。Milo可以在扩大规模和转换为GMP级试剂的过程中分析分化效率,以告知如何修改单个方案以保留或提高分化效率。考虑到这一点,在Milo上运行了用GMP试剂分化的iPSC,NPC和神经元。每个芯片都针对iPSC标记Oct4,NPC标记Pax6和神经元细胞标记Tuj进行了多路复用,以评估分化效率(Figure )。然后将芯片剥离并重新探测以进行装载控制GAPDH。这些结果表明这些细胞成功分化为神经元(Figure 5B)。使用免疫荧光法(Figure 5C)在每个样品中观察到的蛋白质表达模式与Milo报道的一致。但是,使用IF无法轻松量化蛋白质表达和每个样品中表达每种神经标记的细胞百分比。
结论
大脑的复杂性以及支撑其功能的众多CNS细胞类型及网络,需要强大的高分辨率单细胞工具来理解这种复杂性。Milo单细胞Western平台通过分析流式细胞术无法检测到的神经细胞,并提供免疫荧光无法检测到的定量结果,开启了神经生物学研究的新纪元。
参考文献
1.Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signa领. SM Cha-mbers, CA Fasano, EP Papapetrou, M Tomishima, M Sadelain, and L Struder, Nat Biotechnol, 2009; 3:275-280.
2.Efficient generation of region-specific forebrain neurons from human pluripotent stem cells under highly d-efined condition. F Yuan, KH Fang, SY Cao, ZY Qu, R Krencik, M Xu, A Bhattacharyya, YW Su, DY Zhu, and Y Li-u, Sci Rep, 2015, 5:18550
3.Neural subtype specification from human pluripotent stem cells. Y Tao and SC Zhang, Cell Stem Cell, 2016, 19(5): 573-586
4.Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congeni-tal hypomyelination. S Wang, J Bates, X Li, S Schanz, D Chandler-Militello, C Levine, N Maherali, L Studer, K H-ochedinger, M Windrem, and SA Goldman, Cell Stem Cell, 2013, 12(2): 252-264
5.Developmental an-d growth factor-induced regulation of nestin in oligodendrocyte lineage cells. V Gallo and RC Armstrong, J Neurosci, 1995, 15(1): 394-406.
6.Evaluation of commonly used ectoderm markers in iPSC trilineage differentiation. YL Kuang, A Munoz, G Na-lula, KE Santostefano, V Sanghez, G Sanchez, N Terada, AN Mattis, M Iacovino, C Iribarren, RM Krauss, and M-W Medina, Stem Cell Res, 2019; 37: 101434.
(来源:ProteinSimple)
-
- Milo单细胞蛋白质表达定量分析系统
- 品牌:美国ProteinSimple
- 型号:Milo


