SpectraPen SP110手持式光谱仪
SpectraPen SP110手持式光谱仪是一款低成本、多用途手持式光谱仪,广泛用于实验室研究、农业和工业领域。SpectraPen可以测量各种样品的吸收率、反射率、透射率、发射光谱、色彩和荧光分析等(仪器本身不含光源)。
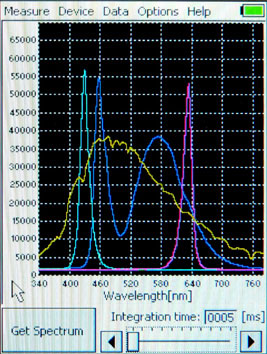
 SpectraPen使用可充电锂电池供电,配有数据采集器和触控屏,不需要使用电脑即可独立进行测量。完整的光谱图及每个波长的光强读数都可以即时显示在触控屏上。SpectraPen还专门内置了测定反射率和透过率的功能。测量数据和光谱图都能够通过USB接口导出到电脑上。
SpectraPen使用可充电锂电池供电,配有数据采集器和触控屏,不需要使用电脑即可独立进行测量。完整的光谱图及每个波长的光强读数都可以即时显示在触控屏上。SpectraPen还专门内置了测定反射率和透过率的功能。测量数据和光谱图都能够通过USB接口导出到电脑上。
应用领域:
植物反射光谱
野外/室内光质分析,如植物生长环境中光质的差异
人工光源质量检测
光学滤波片和保护屏的光谱检测
波长(光色)测量
各类样品的反射率、透射率、荧光和吸收率测量
技术特点:
功能全面的通用高光谱测量仪,可直接测量各种样品的反射光谱,也可加装余弦校正器测量光源的发射光谱。
除直接测量光谱图以外,还可以测量并计算生成透射率和吸收率谱图
手持式仪器,电池供电,无需外部电脑,便于野外测量。
内置GPS
组成:
SpectraPen SP 110提供可测量不同波长范围的两种型号:
SpectraPen SP 110-UVIS波长范围为340-790nm
SpectraPen SP 110-NIR波长范围为640-1050nm
 余弦校正头,用于光源测量(选配)
余弦校正头,用于光源测量(选配)
测量与计算参数:
光谱曲线图
吸收谱图
透射谱图
GPS地理数据
技术参数:
光学探头:带SMA905接头的0.22数值孔径单芯光纤
光谱响应范围:SP 110-UVIS 340-790nm
SP 110-NIR 640-1050nm
光谱响应半宽:SP 110-UVIS 9nm
SP 110-NIR 8nm
余弦校正器(选配):用于测量自然光或人工光源
光谱杂散光:-30dB
波长重现性:+/- 0.5nm
积分时间:5ms-10s
 像素数量:256
像素数量:256
触控屏:240×320像素,65535色
内存:16MB(可存储4000次以上测量数据)
系统数据:16位数模转换
动态范围:高增益 1:4300;低增益 1:13000
通讯方式:USB
内置GPS模块:ZD精度<1.5m
尺寸:15×7.5×4cm
重量:300g
外壳:防水溅外壳
电池:2600mAh可充电锂电池,通过USB接口连接电脑充电
续航时间:可连续测量48小时
工作条件:温度0~55℃,相对湿度0-95%(无冷凝水)
存放条件:温度-10~60℃,相对湿度0-95%(无冷凝水)
产地:捷克
应用案例:
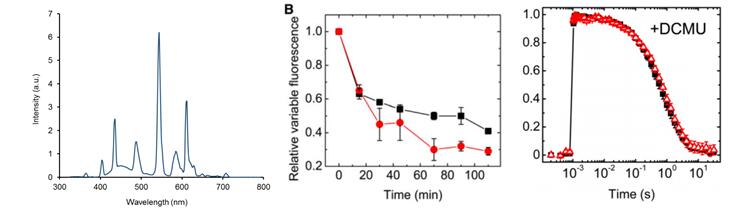
捷克科学院、捷克南波西米亚大学与英国帝国理工学院合作研究了蓝藻光合作用特殊红素氧还蛋白的功能与调节。实验中,SpectraPen光谱仪用于测量培养光照光谱,AquaPen手持式叶绿素荧光仪进行脉冲调制动态荧光测量,FL3500双调制式荧光仪用于QA-再氧化动力学测量。研究成果发表于《Plant Cell》(Kiss,2019)。
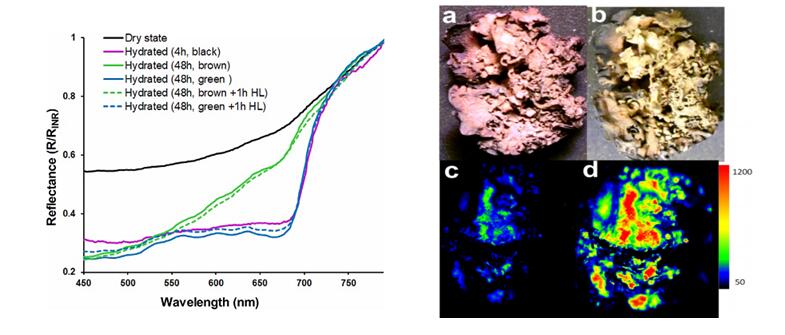
捷克马萨里克大学和捷克科学院合作研究南极地衣的水合作用。研究人员使用SpectraPen光谱仪测量地衣反射光谱变化,同时使用FluorCam叶绿素荧光成像系统对地衣光合系统进行相应的测量(Mishra,2019)。
参考文献
1. Kiss, E., Knoppova, J., Pascual Aznar, G., et al. 2019. A Photosynthesis-Specific Rubredoxin-like Protein Is Required for Efficient Association of the D1 and D2 Proteins during the Initial Steps of Photosystem II Assembly. The Plant Cell 31: 2241-2258
2. Mishra, K. B., Vítek, P., & Barták, M. 2019. A correlative approach, combining chlorophyll a fluorescence, reflectance, and Raman spectroscopy, for monitoring hydration induced changes in Antarctic lichen Dermatocarpon polyphyllizum. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 208: 13–23
3. Fernández-Marín, B., García-Plazaola J. I., Hernández, A., & Esteban, R. 2018. Plant Photosynthetic Pigments:Methods and Tricks for Correct Quantification and Identification. Advances in Plant Ecophysiology Techniques: 29–50.
4. Lazzarini, L. E. S., Bertolucci, S. K. V., P. et al. 2018. Quality and intensity of light affect Lippia gracilis Schauer plant growth and volatile compounds in vitro. Plant Cell, Tissue and Organ Culture (PCTOC).
5. CD Giustina, et al. 2017. Growth f Different Fruit Tree Species In Silvopastoral Systems During The Establishment Phase. Rev. Caatinga 30(4)
6. M Navrátil, et al. 2016. Measurements of reflectance and fluorescence spectra for nondestructive characterizing ripeness of grapevine berries. Photosynthetica 54(1): 101-109
7. P Dąbrowski, et al. 2015. Measuring light spectrum as a main indicator of artificial sources quality. Journal of Coastal Life Medicine 3(5): 398-404
8. D Šebela, et al. 2015. Temporal chlorophyll fluorescence signals to track changes in optical properties of maturing rice panicles exposed to high night temperature. Field Crops Research 177: 75-85
9. P Dąbrowski, et al. 2015. Chlorophyll a fluorescence of perennial ryegrass (Lolium perenne L.) varieties under long term exposure to shade. Zemdirbyste-Agriculture 102(3): 305-312
10. ICA Alvarenga, et al. 2015. In vitro culture of Achillea millefolium L.: quality and intensity of light on growth and production of volatiles. Plant Cell, Tissue and Organ Culture (PCTOC) 122(2): 299-308
北京易科泰生态技术有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒